STUDIENERGEBNISSE
Immuntherapien bei soliden Tumoren: Vom Schwimmer im Strömungskanal

Jörg Wischhusen (links), Professor für Experimentelle Tumorimmunologie an der Universität Würzburg, und Markus Haake, Vice President Pharmacology bei CatalYm, forschen schon seit vielen Jahren am Wachstumsdifferenzierungsfaktor GDF-15. Bild: Dominik Gierke / CatalYm
Unser Immunsystem schützt uns vor körperfremden Eindringlingen oder krankhaft veränderten Zellen. Die Evolution hat jedoch Toleranzmechanismen entwickelt, die das Immunsystem zum Stillhalten bewegen. Ohne solche Toleranzsignale würde ein Embryo, der ja zur Hälfte väterliche Gene hat, vom mütterlichen Immunsystem abgestoßen werden. Aus eben diesem Grund ist die tumorimmunologische Arbeitsgruppe von Prof. Dr. Jörg Wischhusen in der Frauenklinik am UKW angesiedelt. „Wir lernen von der feto-maternalen Toleranz“, erklärt Wischhusen.
GDF-15 schwächt Greifarm der Immunzelle Schon vor vielen Jahren hat der Biochemiker mit seinem Team den Wachstumsdifferenzierungsfaktor GDF-15 (Growth/Differentiation Factor 15) als wichtige Zielstruktur identifiziert. Das Protein GDF-15 führt dazu, dass Immunzellen gar nicht erst zum Fötus gelangen, sondern einfach im Blutstrom am neuen, väterliche Antigene exprimierenden Gewebe vorbeischwimmen. Ein niedriger GDF-15-Spiegel bedeutet für Schwangere ein erhöhtes Risiko, dass ihr Immunsystem den Fötus abstößt. In der Krebstherapie wiederum geht ein erhöhter GDF-15 Spiegel mit einer schlechteren Prognose einher. In einer Studie im Journal Nature Communications konnte die Würzburger Arbeitsgruppe gemeinsam mit CatalYm, einer inzwischen in München beheimateten Ausgründung der Julius-Maximilians-Universität, zeigen, dass GDF-15 ein zentraler Faktor der Resistenz gegen Immuntherapien bei verschiedenen soliden Tumoren ist.
Wie kann GDF-15 die Immunzellen so wirksam hemmen? Hier kommt das Integrin LFA-1 (leukozytenfunktionsassoziiertes Antigen 1) ins Spiel. Seine Bindung an das Adhäsions-Molekül ICAM-1 sorgt für eine entscheidende Zell-Zell-Interaktion, damit aktivierte Immunzellen an ihren Bestimmungsort gelangen. Wischhusen vergleicht die Immunzelle mit einem Schwimmer im Strömungskanal. Nachdem sie im Lymphknoten aktiviert wurde, macht sie sich in der Blutbahn auf den Weg zum Tumor, schafft es aber nicht, sich mit ihren Armen, den Integrinen, an den Griffen im Strömungskanal festzuhalten, sich herauszuziehen und zum Tumor ins Gewebe zu gelangen, um diesen zu bekämpfen. Denn GDF-15 verhindert die Aktivierung der Zelladhäsionsachse LFA-1/ICAM-1, es schwächt gewissermaßen die Schultermuskulatur des Greifarms der Immunzelle.
Gelungene Translation Somit sei GDF-15 ein interessanter Biomarker, aber auch eine Option in der Therapie, betont Dr. Markus Haake, der als ehemaliger Mitarbeiter der AG Wischhusen die CatalYm GmbH mitbegründet hat. Wenn GDF-15 die Rekrutierung von LFA-1-abhängigen T-Zellen blockiert, so könnte wiederum eine Blockade von GDF-15 die Infiltration der Immunzellen in den Tumor und schlussendlich den Erfolg der Immuntherapie verbessern. Mit Visugromab verfügt CatalYm über einen Antikörper, der GDF-15 neutralisiert und mit einer Anti-PD-1-Therapie kombiniert wird. Daten aus der Phase-1-Studie belegen das Potenzial von Visugromab.
Jörg Wischhusen blickt stolz auf die gelungene Translation, die er mit seiner Arbeitsgruppe geschafft hat: „Wir haben den Mechanismus von der Idee über die ersten Daten, Entwicklung eines Antikörpers, Gewinnung von Investoren, dem Liefern weiterer Evidenz aus Modellen und aus klinischen Korrelationen soweit gebracht, dass dieser GDF-15-neutralisierende Antikörper jetzt in klinischen Studien eingesetzt wird.“
Multiples Myelom: CAR-T-Zell-Therapie toppt Standardbehandlung
Jedes Jahr erhalten allein in Deutschland rund 7.000 Menschen die Diagnose Multiples Myelom. Dauerhaft geheilt werden kann diese Krebserkrankung, die von veränderten Plasmazellen im Knochenmark ausgeht, noch nicht. Denn auch nach vermeintlich erfolgreicher Therapie müssen die Betroffenen immer mit einem Rezidiv rechnen. Als große Hoffnungsträger gelten Immuntherapien mit Antikörpern oder Gen-manipulierten T-Zellen, den so genannten CAR-T-Zellen. Prof. Dr. Hermann Einsele, Direktor der Medizinischen Klinik und Poliklinik II des UKW und Sprecher des neu gegründeten NCT WERA, hat eine internationale Studie mitkonzipiert und entwickelt, die jetzt erstmals in randomisierter Form eine Überlegenheit der CAR-T-Zelltherapie gegenüber einer konventionellen Behandlung beim fortgeschrittenen Multiplen Myelom (in der 2. und 4. Therapielinie) gezeigt hat. Die Ergebnisse wurden im New England Journal of Medicine (doi: 10.1056/NEJMoa2303379) veröffentlicht und auf dem europäischen Hämatologen-Kongress in Frankfurt (European Hematology Congress EHA 2023) als Meilenstein in der Myelom-Therapie bewertet.
„In der Phase-3-Studie CARTITUDE-4 konnten wir im direkten Vergleich mit der Standardbehandlung zeigen, dass die CAR-T-Zell-Therapie mit einer einzelnen Cilta-Cel-Infusion zu einem deutlich geringeren Risiko für ein Fortschreiten der Erkrankung oder den Tod führt“, freut sich Hermann Einsele, der bei der Studie als Letztautor fungiert.
Nebennierenkrebs: Bei niedrigem Rückfallrisiko kein Mitotane
Nachdem Martin Fassnacht (Würzburg) und Massimo Terzolo (Turin) im Jahr 2007 im New England Journal of Medicine die grundsätzliche Wirksamkeit von Mitotane beim Nebennierenkarzinom zeigen konnten, hatte sich das Medikament weltweit als Standardtherapie zur Rückfallprophylaxe nach der chirurgischen Entfernung des Tumors etabliert, unabhängig von damals noch unbekannten Risikofaktoren. Mitotane hemmt die Zellteilung in der Nebennierenrinde und wirkt so dem Tumorwachstum entgegen. Das Risiko, dass die Erkrankung nach der Operation wieder auftrat, war in der Kontrollstudiengruppe, die kein Mitotane erhielt, dreimal so hoch wie in der Mitotane-Gruppe. Und das Risiko, an der Erkrankung zu sterben, wurde durch die Therapie nahezu halbiert. Das deutsch-italienische Team hatte neue Standards gesetzt bei der Behandlung des sehr seltenen, aber äußerst aggressiven Tumors.
„Unsere Erkenntnisse von 2007 gelten immer noch, jedoch nur noch für Patientinnen und Patienten mit normalem oder hohem Rezidiv-Risiko“, erklärt Prof. Dr. Martin Fassnacht, Leiter des Lehrstuhls Endokrinologie und Diabetologie am UKW. In der neuen klinischen Studie ADIUVO, die im August 2023 im Journal The Lancet Diabetes & Endocrinology veröffentlicht wurde, hat er mit Massimo Terzolo und weiteren Mitarbeitenden herausgefunden, dass die Gabe von Mitotane nicht nötig ist, wenn die Patientinnen und Patienten drei Faktoren erfüllen und somit das Risiko eines Rückfalls niedrig. Erstens: Die Operation war komplett, sogenannte R0-Resektion. Zweitens: Das Tumorstadium war niedrig, und es hatte noch keine Streuung stattgefunden. Drittens: Der Zellteilungsmarker Ki-67 liegt unter 10 Prozent.
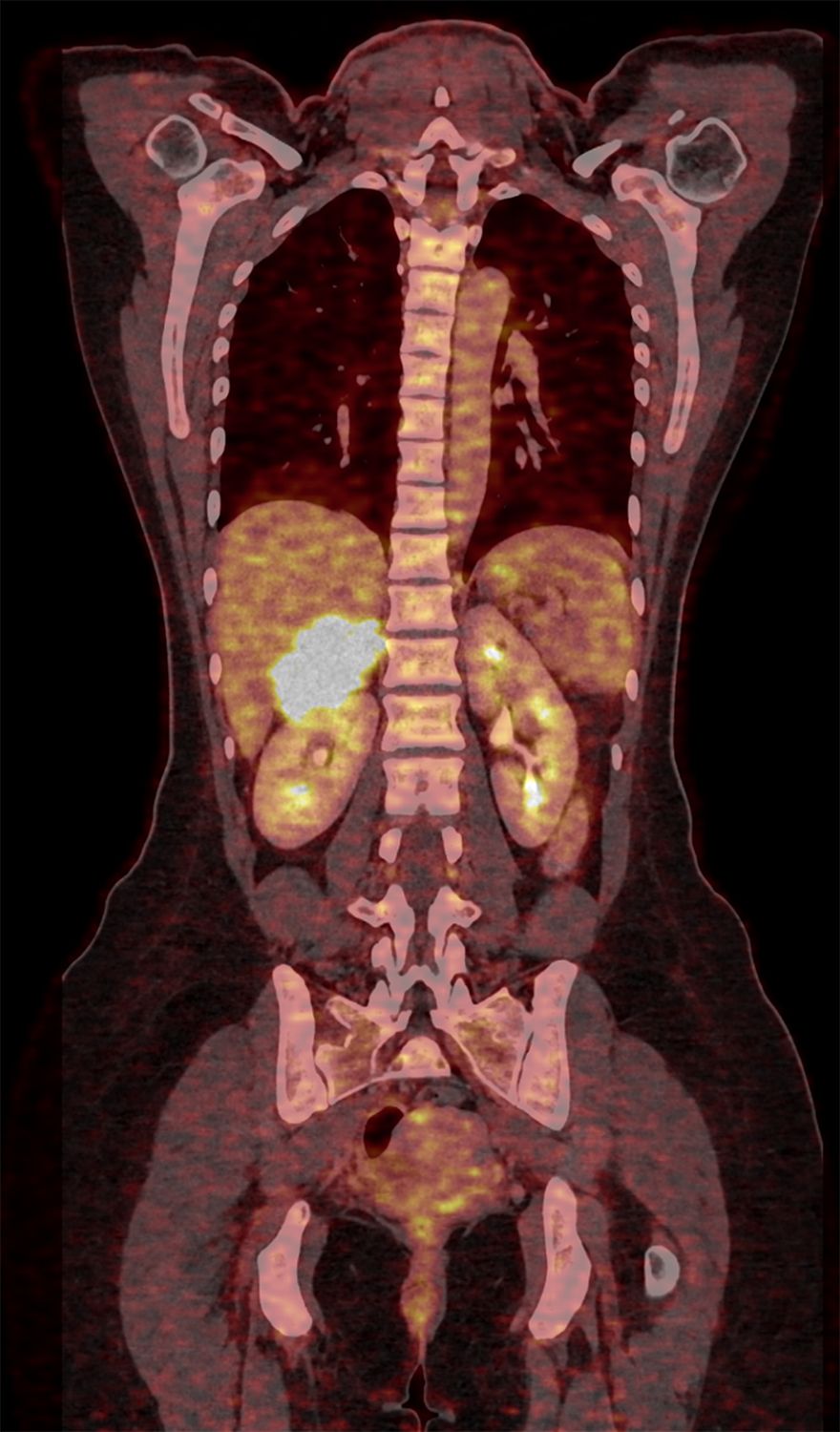
Das Nebennierenkarzinom ist eine bösartige Entartung einer der Hormondrüsen, die paarig jeweils als kleine Kappen der Niere aufsitzen. Mit 80 bis 120 Neuerkrankungen in Deutschland ist der Tumor sehr selten. Daher gibt es nur wenige Kliniken, die auf die Behandlung spezialisiert sind. Die Endokrinologie des UKW ist weltweit das größte Zentrum für die Diagnostik, Therapie und Forschung. Bild: Nuklearmedizin Universitätsklinikum Würzburg