Würzburg. Mehr als 100.000 Menschen in Deutschland sind von einer Muskelkrankheit betroffen. Im Volksmund spricht man oft von Muskelschwund, denn die Abnahme der Muskelmasse ist ein wesentliches Symptom der neuromusklären Erkrankungen, von denen es etwa 800 verschiedene Formen gibt. Da diese oft progressiv verlaufen, schwerwiegend und derzeit nicht heilbar sind, kommt der Forschung im neuromuskulären Bereich eine enorme Bedeutung zu.
Die Förderung der Forschung war daher vor 60 Jahren der Auslöser für die Gründung der Deutschen Gesellschaft für Muskelkranke e.V. (DGM). Mit dem Felix-Jerusalem-Preis zeichnet die DGM beispielsweise junge Wissenschaftlerinnen und Wissenschaftler für Verdienste bei der Erforschung von Pathomechanismen und für objektiv nachvollziehbare Therapieerfolge bei allen Formen neuromuskulärer Erkrankungen aus.
Auf dem diesjährigen DGM-Kongress in Gießen erhielt der Naturwissenschaftler Dr. Patrick Lüningschrör vom Institut für Klinische Neurobiologie am Uniklinikum Würzburg (UKW) am 20. März 2025 den ersten mit 7.500 Euro dotierten Felix-Jerusalem-Preis.
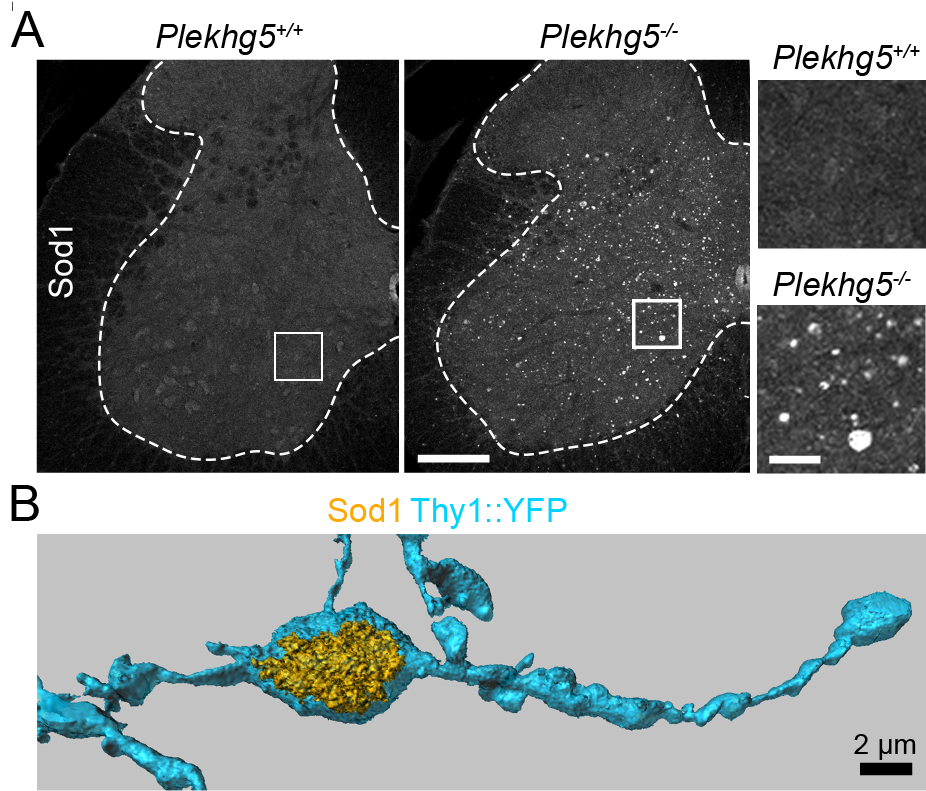
In seiner Studie „Plekhg5 controls the unconventional secretion of Sod1 by presynaptic secretory autophagy“, die in Nature Communications veröffentlicht wurde, konnte Patrick Lüningschrör zusammen mit einem internationalen Team einen unerwarteten pathophysiologischen Mechanismus aufklären, der Nervenzellen vor Schäden schützt. „Wir konnten zeigen, dass der Guanin-Austauschfaktor PLEHG5 die unkonventionelle Sekretion von SOD1 vermittelt. Dieser Mechanismus verhindert, dass sich SOD1 intrazellulär anreichert und zu einer neuronalen Dysfunktion führt“, erklärt Patrick Lüningschrör.
Unerwartete Zusammenarbeit von zwei Proteinen bei Erkrankungen des Motoneurons
Das Überraschende und Interessante an dieser von der DFG und dem BMBF geförderten Studie sei das Zusammenspiel zweier Proteine – SOD1 und PLEKGHG5 - die mit unterschiedlichen Erkrankungen des Motoneurons in Verbindung gebracht werden.
Fehlgefaltete Proteine wie die mutierte Form des Enzyms Superoxid-Dismutase 1 (SOD1) spielen zum Beispiel eine zentrale Rolle bei der familiären Form der Amyotrophen Lateralsklerose (ALS). Und Mutationen in PLEKHG5 sind die Ursache für verschiedene Formen von Motoneuronerkrankungen, die das untere, spinale Motoneuron betreffen. Motoneurone sind die Nerven, deren Impulse die Muskeln in Aktion versetzen.
Ohne PLEKGH5 häuft sich SOD1 in den Nervenzellen an, was zur ALS beitragen kann
Normalerweise werden Proteine von speziellen Zellstrukturen, den Lysosomen, abgebaut. Da SOD1 jedoch sehr stabil ist und dazu neigt toxische Aggregate zu bilden, ist es sehr wichtig, dieses Protein effizient aus den Axonfortsätzen, den langen Ausläufern der Nervenzellen, zu entfernen. „Fehlt das Protein PLEKHG5, bleibt SOD1 in der Zelle stecken und sammelt sich an - ähnlich wie Müll, der nicht entsorgt werden kann und sich stapelt“, beschreibt Patrick Lüningschrör die Entdeckung. Das bedeutet: Eine gestörte Entsorgung von SOD1 kann zur ALS beitragen. „Deshalb ist das Zusammentreffen dieser beiden Proteine in einem gemeinsamen pathophysiologischen Mechanismus klinisch hoch relevant und eröffnet neue therapeutische Ansatzpunkte“, sagt Patrick Lüningschrör.
Erweiterung der Behandlungsmöglichkeiten für größere Patientengruppe
„Kürzlich wurde zum Beispiel mit Toferesen eine effektive Therapie für ALS-Patienten mit SOD1 Mutationen entwickelt. Aufgrund der Erkenntnisse von Lüningschrör und seinem Team gibt es erste Überlegungen, dieses Medikament unter Umständen auch für betroffene Patienten mit PLEKHG5 Mutationen einzusetzen.
In den nächsten Schritten will das Team die gewonnenen Erkenntnisse transnational weiterverfolgen und in präklinischen Studien untersuchen, ob die Akkumulationen von SOD1 tatsächlich die Ursache der PLEKHG5-assozierten Erkrankungen sind. Aus zellbiologischer Perspektive wäre es Lüningschrör zufolge sehr spannend weiter aufzuschlüsseln, wie SOD1 erkannt wird, um aus der Zelle ausgeschleust zu werden.
Publikation: Hutchings AJ, Hambrecht B, Veh A, Giridhar NJ, Zare A, Angerer C, Ohnesorge T, Schenke M, Selvaraj BT, Chandran S, Sterneckert J, Petri S, Seeger B, Briese M, Stigloher C, Bischler T, Hermann A, Damme M, Sendtner M, Lüningschrör P. Plekhg5 controls the unconventional secretion of Sod1 by presynaptic secretory autophagy. Nat Commun. 2024 Oct 4;15(1):8622. doi: 10.1038/s41467-024-52875-5. PMID: 39366938; PMCID: PMC11452647.
Text: KL / Wissenschaftskommunikation