Das kleinzellige Bronchialkarzinom, kurz SCLC (Small Cell Lung Cancer), ist eine besonders aggressive Form von Lungenkrebs. Da die Erkrankung selbst bei Erstdiagnose oft nicht operabel ist, erfolgt die initiale Behandlung meist mit einer Kombination aus Chemotherapie und Immuntherapie in Form eines sogenannten Checkpoint-Inhibitors gegebenenfalls ergänzt durch eine Strahlentherapie. Aufgrund der schnellen Zellteilung kehrt die Krebserkrankung jedoch häufig rasch zurück. Die Prognose insbesondere für die rezidivierte Form des SCLC ist schlecht, die Behandlungsmöglichkeiten sind trotz intensiver Forschung noch begrenzt.
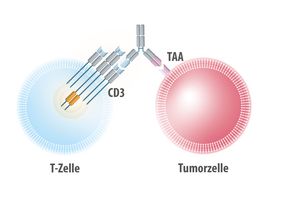
Ein Hoffnungsträger ist der bispezifische T-Zell-Engager (BiTE®) Tarlatamab. Er richtet sich gegen das Protein Delta-like Ligand 3 (DLL3), das auf SCLC-Zellen überexprimiert wird, auf gesundem Gewebe aber kaum vorkommt. Aufgrund seiner bispezifischen Struktur bindet Tarlatamab zusätzlich an T-Zellen und bringt so die Abwehrzellen in die Nähe der Tumorzelle als Ziel. Dadurch werden die T-Zellen aktiviert und zerstören die bösartigen Zellen. Tarlatamab hat bereits in der Phase-I-Studie DeLLphi-300 und der Phase-II-Studie DeLLphi-301 bei vorbehandelten SCLC-Patienten eine anhaltende Anti-Tumor-Wirkung und ein gut kontrollierbares Sicherheitsprofil gezeigt.
Die verlängerte Nachbeobachtung der Phase-I-Studie, die jetzt als „Clinical Trial Update“ im Journal of Clinical Oncology unter der gemeinsamen Federführung des Comprehensive Cancer Center (CCC) Mainfranken am Uniklinikum Würzburg (UKW) und des Seidman Cancer Center der US-Universitätsklinik Cleveland veröffentlicht wurde, zeigte eine mittleren Überlebenszeit von 17,5 Monaten.
Aufgrund dieser Datenlage wurde Tarlatamab in den USA bereits für die Behandlung von Patientinnen und Patienten mit rezidiviertem SCLC zugelassen.
Tumorhemmende und intrakranielle Wirksamkeit
In der Studie wurden insgesamt 152 Patientinnen und Patienten mit rezidiviertem SCLC mit klinisch relevanten Dosen von mindestens 10 mg Tarlatamab behandelt. Bei den Personen, die alle zwei Wochen 10 mg erhielten, betrug die mediane Überlebenszeit sogar 20,3 Monate. In dieser Gruppe konnte bei rund 58 Prozent zumindest eine Krankheitskontrolle durch diese alleinige Immuntherapie erreicht werden. „Als weiteren vielversprechenden Aspekt haben wir beobachtet, dass sich in dieser Patientengruppe, die ein hohes Risiko für Hirnmetastasen hat, nur bei 8 Prozent unter der Therapie neue Hirnmetastasen gebildet haben. Bei einigen Patientinnen und Patienten gingen die Hirnmetastasen um mindestens 30 Prozent zurück, obwohl deren Vorbehandlung mit einer Strahlentherapie schon mehr als 50 Tage zurücklag“, berichtet Dr. Horst-Dieter Hummel, Clinician Scientist in der Early Clinical Trial Unit (ECTU) am Interdisziplinären Studienzentrum (ISZ) des CCC Mainfranken und Zentrumsmanager des Nationalen Netzwerks Genomische Medizin Lungenkrebs (nNGM) am UKW. Positiv sei auch, dass keine neuen Sicherheitsprobleme aufgetreten seien und die Therapie gut verträglich sei.
„Bei guter Verträglichkeit können Patienten mit einer chemotherapiefreien Monoimmuntherapie über Jahre eine Remission erreichen, so dass diese Therapieform tatsächlich eine wesentliche Weiterentwicklung in der Behandlung des SCLC darstellt“, resümiert Horst-Dieter Hummel.
Würzburger Pionierarbeit mit bispezifischen Antikörpern
„Vor dem Hintergrund der sehr eingeschränkten Therapiemöglichkeiten für Patientinnen und Patienten mit rezidiviertem SCLC sind diese Ergebnisse von herausragender klinischer Bedeutung“, freut sich Professor Dr. Ralf Bargou. Der Onkologe und Direktor des CCC Mainfranken leistete bereits seit mehr als 25 Jahren Pionierarbeit in der präklinischen und klinischen Entwicklung der Immuntherapie und etablierte gemeinsam mit seinem Team und dem Team um Prof. Peter Kufer aus München (Amgen Research) das Wirkprinzip der T-Zell-Aktivierung gegen Tumorzellen mittel bispezifischer Antikörper. Für seine Forschungen zum Antikörper Blinatumomab, der gegen CD19 und CD3 gerichtet ist, wurde er mehrfach ausgezeichnet, unter anderem als Erfinder des Jahres von der amerikanischen IPO Education Foundation. Gemeinsam mit der Leiterin des Interdisziplinären Studienzentrums, Dr. Maria-Elisabeth Goebeler, und internationalen Teams konnte er das Konzept der bispezifischen Antikörper in klinisch anwendbare Therapien umsetzen (Ralf Bargou et al, Science, 2008, DOI:10.1126/science.1158545). So gelang es Horst-Dieter Hummel und dem Würzburger ECTU-Team beispielsweise auch, die Wirksamkeit dieses Therapieprinzips beim Prostatakarzinom und damit erstmals bei einem soliden Tumor nachzuweisen (Hummel et al, Immunotherapy, 2021, https://doi.org/10.2217/imt-2020-0256).
Publikation:
Sustained Clinical Benefit and Intracranial Activity of Tarlatamab in Previously Treated Small Cell Lung Cancer: DeLLphi-300 Trial Update
Afshin Dowlati*, Horst-Dieter Hummel*, Stephane Champiat, Maria Eugenia Olmedo, Michael Boyer, Kai He, Neeltje Steeghs, Hiroki Izumi, Melissa L. Johnson, Tatsuya Yoshida, Hasna Bouchaab, Hossein Borghaei, Enriqueta Felip, Philipp J. Jost, Shirish Gadgeel, Xi Chen, Youfei Yu, Pablo Martinez, Amanda Parkes, Luis Paz-Ares*
*Equal contribution: A.D., H.-D.H., and L.P.-A. contributed equally to this work.
Journal of Clinical Oncology, 2024, doi.org/10.1200/JCO.24.00553
Text: Kirstin Linkamp / UKW