Würzburg. In der Schule fielen ihm vor allem Fächer wie Mathematik und Physik leicht. Auch Journalismus hätte ihn interessiert. Aber da brauche man Ellenbogen, um sich durchzusetzen, wurde er gewarnt. Also studierte Johannes Tran-Gia Physik. „Physiker denken analytisch wie Mathematiker, aber sie sind etwas praktischer und flexibler in der Anwendung. Und in der Physik gehen die Leute insgesamt sehr nett miteinander um“, begründet Johannes Tran-Gia seine Studienwahl. Rund 20 Jahre später hat der Würzburger neben einer eigenen Familie mit zwei Kindern einen Master und ein Diplom in Physik, ist promoviert und Privatdozent und seit kurzem Professor. Die von der Deutschen Forschungsgemeinschaft (DFG) für fünf Jahre geförderte Heisenberg-Professur trägt den Titel „Multimodale Bildgebung und Theranostik“ und soll den Weg zu einer Lebenszeitprofessur ebnen, sehr zur Freude der Klinik und Poliklinik für Nuklearmedizin am Uniklinikum Würzburg (UKW). Denn der Bereich der Theranostik, der durch diese Professur gestärkt wird, hat das Potenzial, die Nuklearmedizin zu revolutionieren und eine präzisere und personalisierte Behandlung von Krebs zu ermöglichen.
Theranostik – Therapie und Diagnostik: Der Unterschied liegt in der Art der verwendeten Radionuklide und der Dosis
Unter Theranostik (siehe auch Info-Kasten) versteht man die Kombination diagnostischer und therapeutischer Verfahren. In der Nuklearmedizin werden dazu radioaktiv markierte Arzneimittel sowohl zur Bildgebung als auch zur gezielten Therapie derselben Erkrankung beziehungsweise Pathologie eingesetzt. Der Unterschied liegt in der Art der verwendeten Radionuklide und der Dosis. In der Diagnostik werden kurzlebige Radionuklide genutzt, die eine schwache Strahlung aussenden. Diese Strahlung kann mit speziellen Kameras sichtbar gemacht werden, um damit Stoffwechselvorgänge und Funktionsstörungen im Körper zu visualisieren. In der Therapie hingegen werden langlebigere Radionuklide verwendet, die eine hochenergetische Strahlung aussenden. Diese Strahlung zerstört gezielt erkranktes Gewebe wie Tumorzellen, während das umliegende Gewebe weitgehend geschont wird.
Dosimetrie: Bestimmung und Bewertung der Energiedosis, um Wirksamkeit zu maximieren und Nebenwirkungen zu minimieren
Doch welche Dosierung des radioaktiven Arzneimittels ist die richtige, um eine maximale therapeutische Wirkung bei minimalen Nebenwirkungen zu erzielen? Mit dieser Frage beschäftigt sich die Dosimetrie, ein wesentlicher Bestandteil bei der Einführung neuer Radionuklidtherapien und ein Forschungsschwerpunkt der Würzburger Nuklearmedizin. „Wie hoch kann ich mit der therapeutischen Aktivität gehen? Nachdem zuvor die Radiochemie die Hauptarbeit in der Entwicklung eines Radiopharmakons hatte, kommt hier die Physik ins Spiel“, so Johannes Tran-Gia, der auch im entsprechenden Ausschuss (Dosimetry Committee) der europäischen Fachgesellschaft für Nuklearmedizin (European Association of Nuclear Medicine, EANM) aktiv ist. Er setzt damit das fort, was Prof. Dr. Michael Laßmann während seiner langjährigen Tätigkeit als Leiter der Medizinischen Physik der Würzburger Nuklearmedizin begonnen hat. In seinem Heisenberg-Projekt geht es denn auch konkret um die „bildgebungsbasierte Individualisierung der Knochenmarkdosimetrie für Radionuklidtherapien“. Durch den Einsatz bildgebender Verfahren soll die Energiedosis für jede Patientin und jeden Patienten individuell bestimmt werden. Dadurch soll künftig die Therapieaktivität personalisiert und somit die Therapie noch wirksamer und schonender gestaltet werden.
Mit neuen bildgebenden Verfahren die Energiedosis im roten Knochenmark genauer bestimmen
Das rote Knochenmark ist eines der Hauptrisikoorgane vieler Radionuklidtherapien, da es aufgrund der hohen Zellteilungsrate besonders strahlenempfindlich ist. Seine Schädigung kann zu schwerwiegenden Nebenwirkungen führen, zum Beispiel Blutarmut durch Mangel an roten Blutkörperchen, Immunschwäche durch Mangel an weißen Blutkörperchen und Blutungsneigung durch Mangel an Blutplättchen. Die Messung der Energiedosis auf das rote Knochenmark ist laut Tran-Gia jedoch besonders schwierig, da nicht die Aktivität im gesamten Knochenmark, sondern gezielt im blutbildenden roten Knochenmark bestimmt werden muss. „Deshalb haben wir spezielle multimodale Bildgebungsverfahren wie dedizierte Magnetresonanztomographie- oder CT-Techniken entwickelt, um den Fett-, Wasser und Knochenanteil im Knochenmark zu bestimmen und so die für die Berechnung der Energiedosis relevante Masse des roten Knochenmarks zu quantifizieren“, sagt Tran-Gia. Validiert werden die Verfahren durch Messungen an 3D-Modellen, die er mit seinem Team im 3D-Drucklabor selbst herstellt. „Mit unseren neuen bildgebenden Verfahren können wir die Verteilung der radioaktiven Substanzen im Körper genauer verfolgen und so die Dosis auf das rote Knochenmark präziser bestimmen“, ergänzt Tran-Gia. Parallel dazu arbeitet er daran, die Bildgebung mit Hilfe von künstlicher Intelligenz zu beschleunigen, um diese in der klinischen Routine effizienter einsetzen zu können. Die Verbesserung dieser Bildgebung war auch das Thema seiner Habilitation. In Zusammenarbeit mit dem National Physics Laboratory in Großbritannien und führenden europäischen Kliniken hat er zudem ein Standardisierungsverfahren für die quantitative Bildgebung in der Dosimetrie entwickelt, um sowohl europaweit als auch weltweit vergleichbare Messergebnisse zu gewährleisten (publiziert in EJNMMI Physics DOI: 10.1186/s40658-021-00397-0).
Prätherapeutische Dosimetrie: Der erste Schritt zur personalisierten Radionuklidtherapie
Auch die Nieren spielen eine wichtige Rolle bei der Dosimetrie, da die meisten radioaktiven Arzneimittel über die Niere ausgeschieden werden und diese daher besonders belastet sind. Derzeit werden die meisten Radionuklidtherapien jedoch mit einer Standarddosierung verabreicht, ohne Rücksicht auf individuelle Unterschiede. „Das bedeutet, dass ein 150 Kilo schwerer Holzfäller die gleiche Therapieaktivität erhält wie eine 50 Kilo leichte zierliche ältere Dame, obwohl ihre Stoffwechsel ganz unterschiedlich sind“, erläutert Johannes Tran-Gia. Das habe zur Konsequenz, dass man das Risiko in Kauf nimmt, neun von zehn Patientinnen und Patienten zu unterdosieren, um eine Person mit einem niedrigeren Stoffwechsel zu schützen. Prätherapeutische Dosimetrie könnte hier Abhilfe schaffen: Durch eine Voruntersuchung ließe sich bestimmen, welcher Strahlenexposition die Nieren des einzelnen Patienten tatsächlich ausgesetzt wären. So könnte die therapeutische Aktivität oder die Anzahl der Therapiezyklen individuell angepasst werden. Diese Voruntersuchungen, die ein erster Schritt auf dem Weg zur personalisierten Radionuklidtherapie wären, werden derzeit jedoch nicht von den Krankenkassen finanziert.
„Es findet gerade ein großer Umbruch statt, den ich mitgestalten kann“
Die individualisierte Radionuklidtherapie gewinnt zunehmend an Bedeutung – nicht zuletzt angesichts der weltweit steigenden Zahl diagnostizierter Krebserkrankungen und den damit verbundenen gesellschaftlichen Herausforderungen. „Hier werden wir in den nächsten Jahren große Fortschritte sehen“, ist sich Johannes Tran-Gia sicher. Ein besonders relevantes Anwendungsfeld ist das Prostatakarzinom, an dem jeder vierte Mann im Laufe seines Lebens erkrankt. In Deutschland ist es nach Lungenkrebs die zweithäufigste zum Tode führende Krebserkrankung bei Männern. „Das Krankheitsbild hat daher eine enorme Relevanz und einen riesigen Markt“, erklärt Tran-Gia.
Deutschland nimmt bei der Dosimetrie der Radionuklidtherapie eine führende Rolle ein, da Patientinnen und Patienten aus strahlenschutzrechtlichen Gründen während der Behandlung mindestens zwei Tage stationär bleiben müssen. „In dieser Zeit können wir viele der für die Dosimetrie wichtigen Messungen durchführen. Unser Ziel ist es, die Energiedosis in Risikoorganen wie den Nieren künftig im Arztbrief zu dokumentieren. Dadurch könnten retrospektiv Korrelationen zwischen Energiedosis und Nebenwirkungen hergestellt werden. Im Idealfall kommen dann noch weitere Parameter wie Geschlecht, Lebensstil und klinische Daten hinzu, so dass man eines Tages vielleicht sogar vorhersagen kann, wie empfindlich Menschen mit einer bestimmten Vorgeschichte auf die Strahlung reagieren, beispielsweise ob sie Raucher waren oder übergewichtig,“ erklärt Tran-Gia. Positiv für sein Forschungsfeld bewertet Johannes Tran-Gia auch, dass Deutschland durch das Medizinforschungsbeschleunigungsgesetz die Zulassung von Radionuklidtherapien erleichtern und bürokratische Hürden abbauen will.
„Es findet gerade ein großer Umbruch statt, den ich mitgestalten kann“, freut sich Tran-Gia. Die Professur in Würzburg sei für ihn wie ein Sechser im Lotto. Er brenne für diese Forschung, die viel Potenzial habe, sehr interdisziplinär sei und zudem sehr nah am Patienten.
Werdegang von Johannes Tran-Gia
Johannes Tran-Gia wurde 1984 in Stuttgart geboren. Nach einer Zwischenstation in Zürich zog seine Familie noch im Kindergartenalter nach Würzburg, wo sein Vater, der 2023 verstorbene Phuoc Tran-Gia, einen Ruf auf den Lehrstuhl für Informatik III „Kommunikationsnetze“ annahm. Phuoc Tran-Gia war ein herausragender, international renommierter Wissenschaftler, der zwei Jahre Dekan der Fakultät für Mathematik und Informatik und drei Jahre Vizepräsident der Julius-Maximilians-Universität Würzburg gewesen war und 2020 zum Ehrenbürger ernannt wurde. Durch dessen Forschungs- und Lehrtätigkeit und zahlreiche Auslandsaufenthalte lernte Johannes Tran-Gia schon früh den Wissenschaftsbetrieb kennen. Er studierte Physik in Würzburg und Edinburgh, machte seinen Master in Schottland und später sein Diplom in Würzburg. Nach einer zehnmonatigen Weltreise promovierte er am Institut für Diagnostische und Interventionelle Radiologie des UKW mit einem durch die Exzellenzinitiative geförderten Stipendium der Graduate School of Life Sciences (GSLS) zum Thema „Modellbasierte Rekonstruktionsmethoden für die MR-Relaxometrie“. Besonders gefielen ihm die medizinischen und praktischen Aspekte seiner Arbeit. Während seiner Promotionszeit und darüber hinaus baute er am UKW sowie auf zahlreichen Dienstreisen ein breites Netzwerk an Kooperationen auf und forschte unter anderem ein halbes Jahr lang als Postdoc an der Case Western Reserve University in Cleveland, USA. Zurück in Würzburg spezialisierte sich Johannes Tran-Gia als wissenschaftlicher Mitarbeiter in der Nuklearmedizin und schloss die Weiterbildung zum Medizinphysik-Experten (MPE) ab. Anschließend habilitierte er sich in der Arbeitsgruppe „Medizinische Physik“. Mit Wirkung zum 20.12.2024 wurde Johannes Tran-Gia zum W2-Universitätsprofessor für „Multimodale Bildgebung und Theranostik“ an der Universität Würzburg ernannt – zunächst für die Dauer von fünf Jahren.
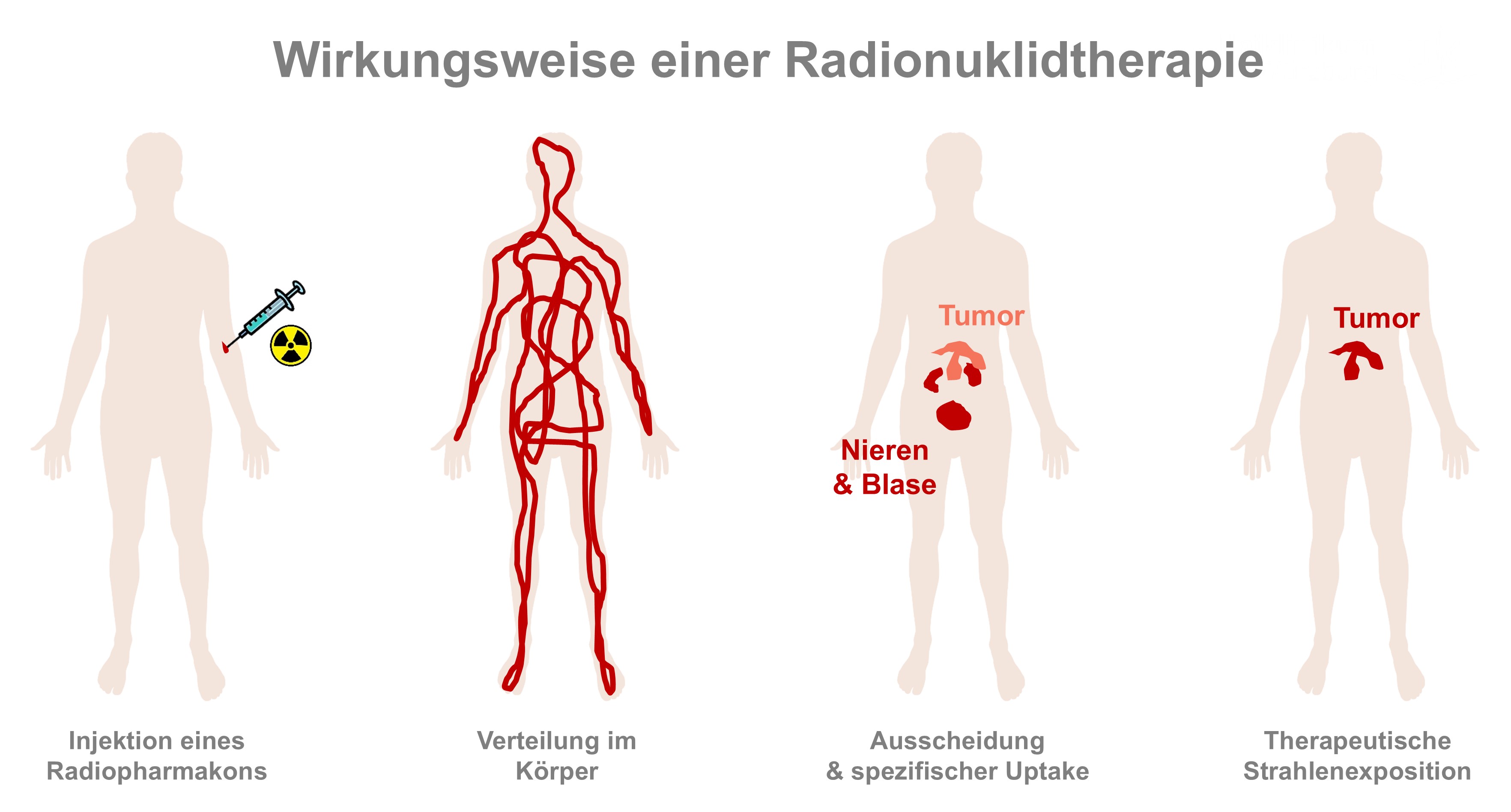
Was ist Theranostik
Theranostik setzt sich aus den Wörtern Therapie und Diagnostik zusammen. Sie kombiniert die Spezifität der molekularen Zielerkennung mit der therapeutischen Wirksamkeit von Strahlung. Der Unterschied zwischen Diagnostik und Therapie mit radioaktiven Substanzen liegt in der Art der verwendeten Radionuklide. Um festzustellen, wo und wie sich Krebszellen im Körper verteilen, wird ein radioaktives Arzneimittel mit einem Isotop schwach ionisierender Strahlung injiziert. Dieses gibt so genannte Gammastrahlung ab, die den Körper nahezu ungehindert durchdringt und mit bildgebenden Verfahren wie SPECT (Single Photon Emission Computed Tomography) oder PET (Positronen-Emissions-Tomographie) von außen nachgewiesen werden kann. Die radioaktive Substanz wird an ein spezifisches Trägermolekül (Pharmakon) gebunden, das gezielt Krebszellen anhand ihrer charakteristischen Zielstrukturen wie Rezeptoren, Proteinen oder Antigenen erkennt und dort bindet. Nach der Verabreichung des so genannten Tracers verteilt sich das Radiopharmakon im Körper und reichert sich im Tumorgewebe an. Sobald der Tracer zerfällt und ausgeschieden wird, bleibt nur noch der so genannte spezifische Uptake in den Krebszellen sichtbar. Bei der Diagnostik ist die Strahlenexposition sehr gering und laut Johannes Tran-Gia vergleichbar mit der eines Vielfliegers. Bei der Radionuklidtherapie werden die Trägermoleküle mit Radionukliden markiert, die Beta- oder Alphateilchen abgeben. Diese Teilchenstrahlung hat eine sehr geringe Reichweite und induziert lokal Strahlenschäden, wodurch Tumorgewebe gezielt zerstört werden kann, während das umliegende Gewebe weitgehend geschont wird.
Text: KL / Wissenschaftskommunikation