So unterschiedlich sich Autoimmunerkrankungen wie beispielsweise Multiple Sklerose, entzündliches Rheuma oder Schuppenflechte, aber auch sämtliche Formen von Krebs auf die Betroffenen auswirken – ein Merkmal ist ihnen allen gemeinsam: Sie alle gehen mit einer gesteigerten Zellvermehrung einher. Dementsprechend müssen die Zellen die Produktion von molekularen Bausteinen kräftig steigern, was zwangsläufig mit einem stark erhöhten Energiebedarf dieser Zellen einhergeht.
Daher ist die Kontrolle über die zelluläre Energiegewinnung und die Produktion molekularer Bausteine eine wichtige Strategie bei der Entwicklung neuer Medikamente gegen solche Krankheiten. Einem Team von Wissenschaftlerinnen und Wissenschaftlern der Julius-Maximilians-Universität Würzburg (JMU) ist dabei jetzt ein wichtiger Schritt gelungen. Über bisher ungenutzte pharmakologische Angriffspunkte konnte es Einfluss auf diese zellulären Prozesse nehmen.
Publikation in Nature Communications
Hauptautorin der jetzt in der Fachzeitschrift Nature Communications veröffentlichten Studie ist Antje Gohla, Professorin für Biochemische Pharmakologie am Lehrstuhl für Pharmakologie und Toxikologie der JMU. Daran beteiligt waren Teams vom Rudolf-Virchow-Zentrum (RVZ) für Integrative und Translationale Bildgebung, dem Biozentrum und dem Institut für Pharmazie der JMU sowie vom Leibniz Institut für Molekulare Pharmakologie-FMP Berlin und dem Leibniz Institut für Analytische Wissenschaften-ISAS Dortmund.
„Ein typischer Angriffspunkt bei der Entwicklung neuer Wirkstoffe ist die Vorliebe vieler Zellen für Zucker in Form von Glukose als Hauptenergie- und Baustein-Lieferant, denn Glukose kann im Stoffwechsel quasi als Allzweck-Molekül verwendet werden“, erklärt Antje Gohla. Allerdings sei der therapeutische Erfolg dieser Strategie bisher begrenzt.
Dabei sei ein wichtiger Aspekt des menschlichen Stoffwechsels von der Forschung lange Zeit ignoriert worden: „Parallel zu den bereits gut bekannten Ab-, Um-, und Aufbauwegen von Glukose laufen im Untergrund auch verschiedene ‚Reparaturprozesse‘ ab, die für einen kontinuierlichen, reibungslosen Stoffumsatz nötig sind“, erklärt Gohla.
Blockade an wichtigen Reparaturprozessen
Auf diese Prozesse hat sich das Forschungsteam in seiner jetzt veröffentlichten Studie konzentriert. Die Wissenschaftlerinnen und Wissenschaftler sind dafür der Frage nachgegangen, ob sich derartige Reparaturprozesse als Angriffspunkte von Medikamenten eignen könnten. Die Antwort ist eindeutig: „Wir konnten erstmals einen Wirkstoff identifizieren, der zielgerichtet die Aktivität der sogenannten Phosphoglykolat-Phosphatase hemmt, eines wichtigen Reparatur-Enzyms im Zuckerstoffwechsel“, erklärt die Pharmakologin. Im Reagenzglas haben diese Wirkstoffe wie erhofft die Vermehrung von Tumorzellen blockiert.
Phosphatasen gelten prinzipiell als komplizierte pharmakologische Zielstrukturen. Dementsprechend froh ist das Team, dass es ihm gelungen ist, einen strukturell neuartigen Phosphatase-Inhibitor zu identifizieren und zu charakterisieren.
Wichtige Unterstützung aus der Strukturbiologie
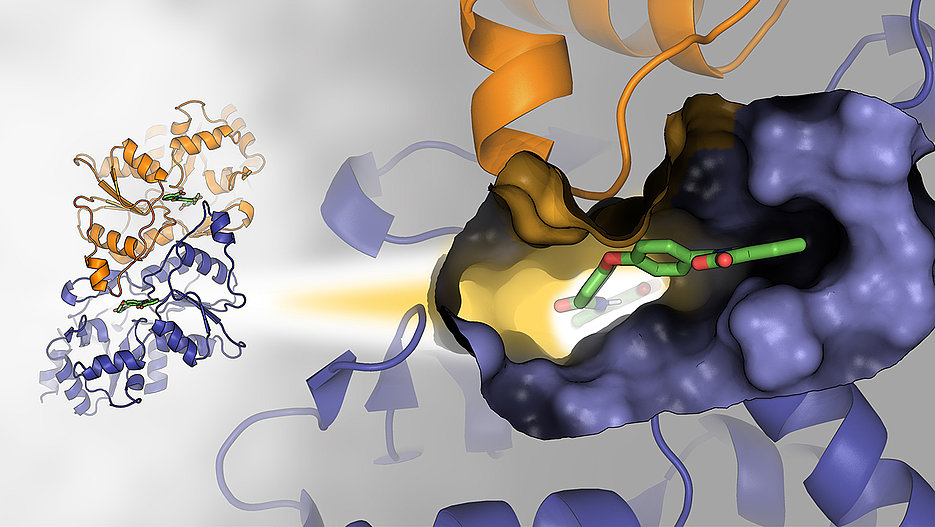
Unterstützung erhielt Gohla bei dieser Suche von Expertinnen und Experten aus dem Hochdurchsatz-Screening, der Metabolismus-Analytik, Strukturbiologie und Medizinalchemie. Mit deren Hilfe sei es gelungen, in detaillierten Untersuchungen den molekularen Wirkmechanismus eines Hemmstoffs der Phosphoglykolat-Phosphatase aufzuklären.
Einen wesentlichen Beitrag dazu lieferte Professor Hermann Schindelin vom Rudolf-Virchow-Zentrum durch die Aufklärung der dreidimensionalen Struktur der Phosphoglykolat-Phosphatase im Komplex mit dem Wirkstoff mittels Röngtenkristallstrukturanalyse. „Die Visualisierung des Wirkstoffs in räumlicher Nachbarschaft zum aktiven Zentrum erklärt nicht nur die enzymkinetischen Daten, sondern liefert vor allem einen Startpunkt für die zukünftige Entwicklung einer neuen Generation von Hemmstoffen mit verbesserten Bindungseigenschaften“, führt der Strukturbiologe aus.
Perspektive für neue Therapien
Insgesamt zeigen die Ergebnisse, dass es noch bisher ungenutzte pharmakologische Angriffspunkte im zellulären Zuckerstoffwechsel gibt. Während sich die Forschung bislang auf die Haupt-Stoffwechselwege der Glukose konzentriert habe, die auch für viele gesunde Zellen lebenswichtig sind, zielt dieser neue Ansatz auf den gesteigerten Bedarf an Reparaturprozessen im hochaktiven Stoffwechsel krankheitsassoziierter Zellen ab. „Das Konzept ist also, mit einem pharmakologischen Ansatz dafür zu sorgen, dass sich beispielsweise Tumorzellen oder fehlgesteuerte Immunzellen abhängig von ihrer Stoffwechselaktivität durch das Anhäufen toxischer Nebenprodukte selbst ausbremsen oder sogar vergiften“, erklärt Gohla.
Bis der neue Wirkstoff als Medikament zur Behandlung von Autoimmunkrankheiten oder Krebs eingesetzt werden kann, ist es allerdings noch ein weiter Weg. Die Autorinnen und Autoren der Studie hoffen jedoch, dass sich auf Basis ihrer grundlegenden Untersuchungen in Zukunft neue Perspektiven bei der Behandlung von Tumoren, Autoimmunkrankheiten oder chronisch-entzündlichen Erkrankungen auftun.
Originalpublikation
Glycolytic flux control by drugging phosphoglycolate phosphatase. Elisabeth Jeanclos, Jan Schlötzer, Kerstin Hadamek, Natalia Yuan-Chen, Mohammad Alwahsh, Robert Hollmann, Stefanie Fratz, Dilan Yesilyurt-Gerhards, Tina Frankenbach, Daria Engelmann, Angelika Keller, Alexandra Kaestner, Werner Schmitz, Martin Neuenschwander, Roland Hergenröder, Christoph Sotriffer, Jens Peter von Kries, Hermann Schindelin, Antje Gohla. Nature Communications, DOI: 10.1038/s41467-022-34228-2
Kontakt
Prof. Dr. Antje Gohla, Lehrstuhl für Pharmakologie und Toxikologie, T: +49 931 31-80099, antje.gohla@uni-wuerzburg.de
einBlick - Das Online-Magazine der Universität Würzburg vom 15.11.2022