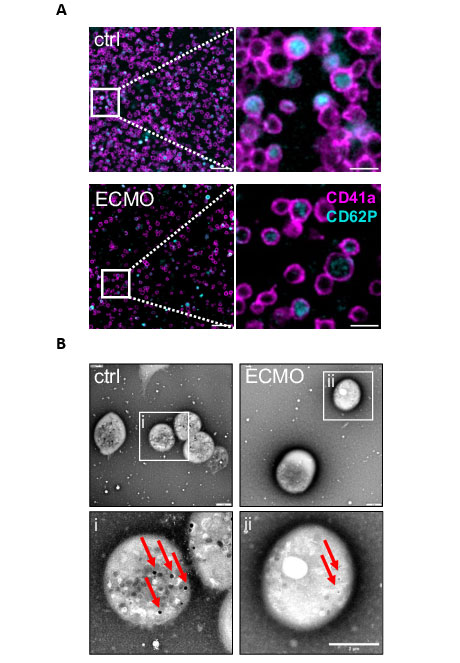
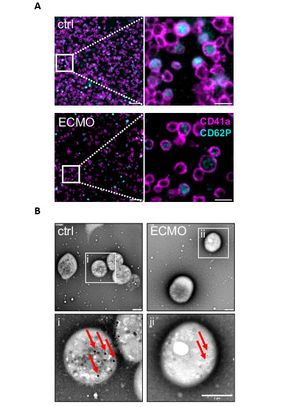
Das intensivmedizinische Verfahren, bei dem zuvor entnommenes Blut mit Sauerstoff angereichert und wieder zurückgeführt wird, kann jedoch zu erheblichen Veränderungen der Blutgerinnung führen und das Blutungsrisiko erhöhen. In einem translationalen Forschungsprojekt konnten die Forschenden einerseits zeigen, dass die ECMO-Therapie zu einer Entleerung zellulärer Speicher (δ-Granula) in den Blutplättchen, den so genannten Thrombozyten, führt, wodurch die Blutungszeit verlängert wird. Andererseits fanden sie Hinweise auf eine Reduktion des Glykoprotein-V-Rezeptors auf der Oberfläche der Thrombozyten, was das Sterberisiko erhöht. Diese Ergebnisse bauen auf Würzburger Vorarbeiten auf, in denen dem Glykoprotein-V-Rezeptor eine wichtige Rolle bei der Blutgerinnung und damit ein möglicher neuer Angriffspunkt zur Verhinderung von Blutungsereignissen unter ECMO-Therapie zugeschrieben werden konnte.
Johannes Herrmann, Lukas J. Weiss, Bastian Just, Kristina Mott, Maria Drayss, Judith Kleiss, Jonathan Riesner, Quirin Notz, Daniel Röder, Rainer Leyh, Sarah Beck, Dirk Weismann, Bernhard Nieswandt, Christopher Lotz, Patrick Meybohm, Harald Schulze. ECMO aggravates platelet GPV shedding and δ-granule deficiency in COVID-19-associated acute respiratory distress syndrome. Journal of Thrombosis and Haemostasis, ISSN 1538-7836 (2024). doi:10.1016/j.jtha.2024.05.008
Die Studie wurde gefördert von der European Society of Intensive Care Medicine (ESICM) und der Deutschen Forschungsgemeinschaft (DFG) im Rahmen des SFB 1525.