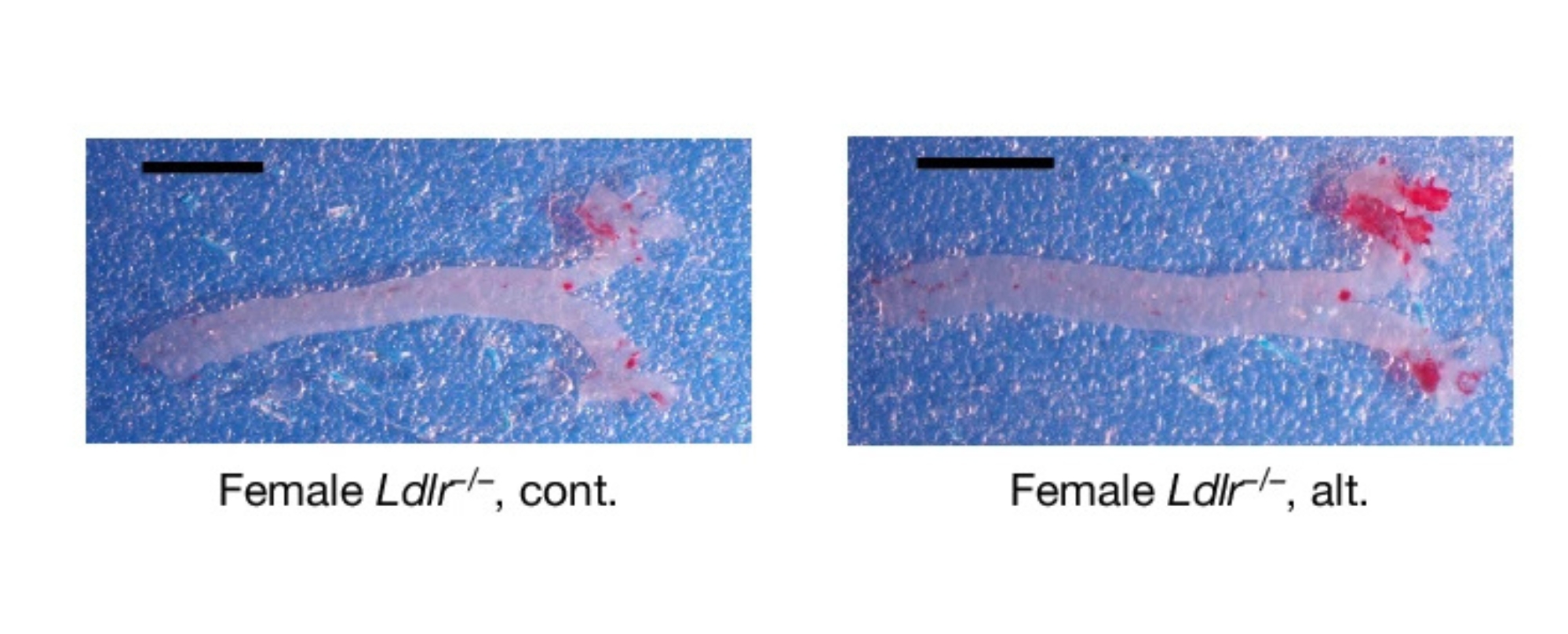
Um diese Frage zu beantworten, hat ein internationales Team um Hafid Ait-Oufella, Paris, unter Beteiligung der Experimentellen Biomedizin II und des HIRI ein Protokoll entwickelt, in dem Mäuse, die zu Atherosklerose neigen, einer alternierenden und einer kontinuierlichen fettreichen Diät ausgesetzt wurden.
Die in der renommierten Fachzeitschrift Nature veröffentlichten Ergebnisse zeigten, dass die alternierende Diät die Atherosklerose stärker beschleunigte als die kontinuierliche fettreiche Diät. Der Grund dafür liegt im Knochenmark: Durch das ständige Auf und Ab der fettreichen Ernährung werden Vorläuferzellen des Immunsystems umprogrammiert.
Dieser Effekt trat auch bei Mäusen auf, denen bestimmte Immunzellen (T-, B- und natürliche Killer-T-Zellen) fehlten, so dass das so genannte adaptive Immunsystem nicht die Ursache sein konnte. Die Unterbrechung der fettreichen Diät in der Gruppe mit der alternierenden Diät veränderte die Aktivität eines Gens namens RUNX1, wodurch die Entzündungsprozesse im Knochenmark verstärkt wurden. Sobald die Mäuse wieder fettreiches Futter bekamen, reagierte ihr Körper mit einer überschießenden Entzündungsreaktion. Vor allem das Molekül IL-1β spielte dabei eine Schlüsselrolle. Die vermehrten Neutrophilen wanderten in die Gefäßablagerungen ein, setzten entzündungsfördernde Substanzen frei und verstärkten die Atherosklerose.
Als die Forschenden die Neutrophilen gezielt entfernten oder den IL-1β-Signalweg blockierten, verschwanden die negativen Effekte der wechselnden fettreichen Ernährung. Folglich können nicht nur eine dauerhaft ungesunde Ernährung, sondern auch häufige Ernährungswechsel das Risiko für Herz-Kreislauf-Erkrankungen erhöhen.
Lavillegrand JR, Al-Rifai R, Thietart S, Guyon T, Vandestienne M, Cohen R, Duval V, Zhong X, Yen D, Ozturk M, Negishi Y, Konkel J, Pinteaux E, Lenoir O, Vilar J, Laurans L, Esposito B, Bredon M, Sokol H, Diedisheim M, Saliba AE, Zernecke A, Cochain C, Haub J, Tedgui A, Speck NA, Taleb S, Mhlanga MM, Schlitzer A, Riksen NP, Ait-Oufella H. Alternating high-fat diet enhances atherosclerosis by neutrophil reprogramming. Nature 634, 447–456 (2024). https://doi.org/10.1038/s41586-024-07693-6