Cannabis aktiviert verschiedene G-Protein-gekoppelte Rezeptoren und kann bei fortwährendem Konsum Bradykardie (verlangsamter Herzschlag) und Hypotonie (niedriger Blutdruck) verursachen. Zudem legen in vitro Studien nahe, dass Stimulation von Cannabinoid-Rezeptoren die Kontraktionskraft und Hypertrophie von Kardiomyozyten, also die stress-bedingte Zunahme der Zellgröße, beeinflussen könnten.
Forschende aus München, Würzburg und Aachen um Sarah-Lena Puhl vom Institute for Cardiovascular Prevention (IPEK) an der Ludwig-Maximilians-Universität (LMU) und dem DZHI am UKW haben nun die Rolle des Cannabinoid-sensitiven Rezeptors GPR55 in der Regulation der Herzfunktion, des Kardiomyozyten-Stoffwechsels und der Hypertrophie an Mäusen untersucht. Dabei zeigte sich, dass dieser Rezeptor besonders bei weiblichen Mäusen eine wichtige Rolle bei der Regulierung der Funktion von Herzmuskelzellen und deren Reaktion auf Belastungen wie Bluthochdruck hat.
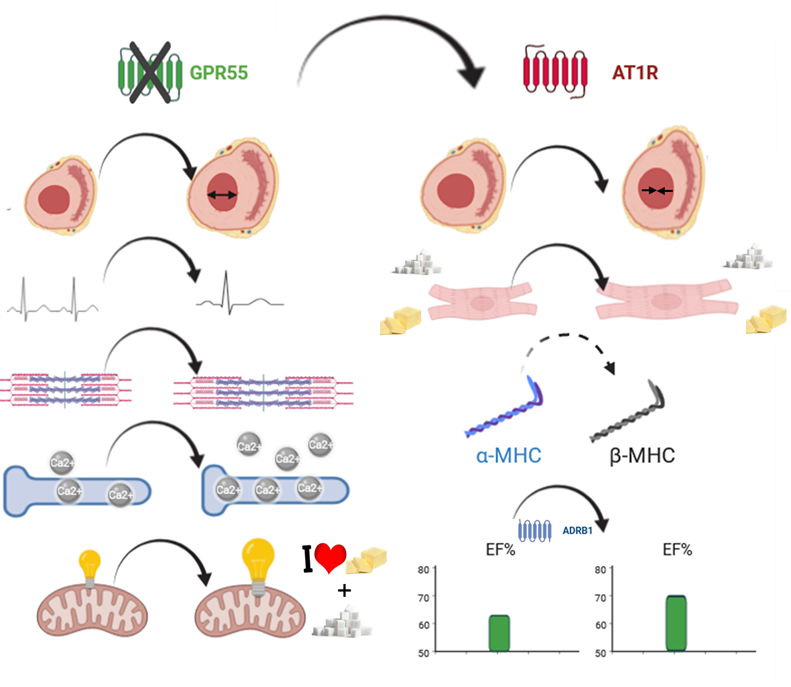
Weibliche Mäuse ohne GPR55 zeigten in Abwesenheit kardialer Belastung bereits eine veränderte Herzfunktion und Struktur: ein größeres Füllungsvolumen, verlangsamten Herzschlag und schnellere Kontraktionen der kontraktilen Einheiten der Herzmuskelzellen, der Sarkomere. Diese Veränderungen waren verbunden mit einer Hochregulation von Faktoren, die den Glukose- und Fettsäuretransport fördern, sowie einer beschleunigten mitochondrialen Atmung. Bei experimentell erzeugter hypertensiver Herzerkrankung (durch das Hormon Angiotensin II) schützte die GPR55-Defizienz die weiblichen Herzen vor schädlichen Veränderungen, wie gestörtem Stoffwechsel und Verlust der Fähigkeit, die Pumpleistung des Herzens zu erhöhen, um unter Stressbedingungen den erhöhten Blutversorgungsbedarf des Körpers zu decken (kontraktile Reserve).
Das heißt: Insbesondere in weiblichen Mäusen modifiziert ein Fehlen der GPR55 Aktivität Herzfunktion und -stoffwechsel erheblich und mildert die maladaptiven Umbauprozesse des Herzens als Antwort auf Belastungen, wie Bluthochdruck, ab. GPR55 könnte also ein vielversprechendes Ziel für neue Behandlungen sein, um hypertensive Herzkrankheiten – insbesondere bei Frauen – zu behandeln. Der Rezeptor bietet demnach potentielle, neue Ansätze, um schädliche Anpassungen des Herzens bei druck-induzierten Herzerkrankungen entgegen zu wirken.
Brigitte Schopohl, Michael Kohlhaas, Alexander G. Nickel, Anna-Florentine Schiuma, Sanne L. Maas, Emiel P. C. van der Vorst, Yi Xuan Shia, Christoph Maack, Sabine Steffens, Sarah-Lena Puhl. Gpr55 deficiency crucially alters cardiomyocyte homeostasis and counteracts angiotensin II induced maladaption in female mice. Br J Pharmacol. 2025 Feb;182(3):670-691. doi: 10.1111/bph.17350. Epub 2024 Oct 20. PMID: 39428581.