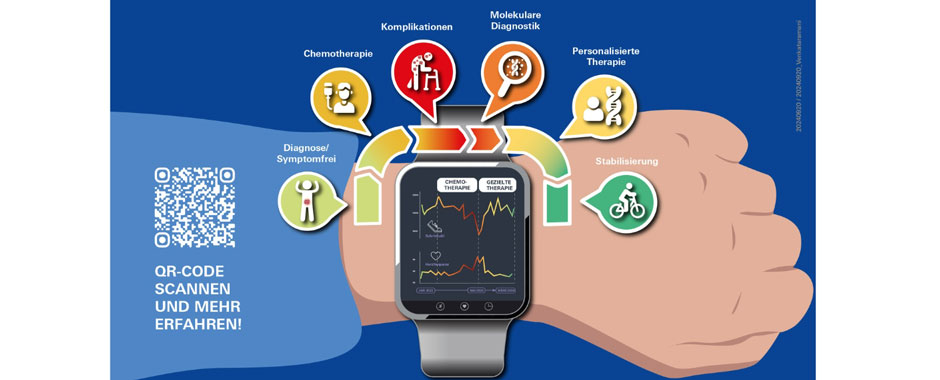
Die Publikation zeigt nicht nur die mögliche Wirksamkeit präzisionsonkologischer Behandlungen, sondern auch das medizinisch hilfreiche Potenzial digitaler Instrumente wie Smartwatches. Diese so genannten Wearables könnten die Überwachung von Krebsbehandlungen positiv beeinflussen und so eine schnelle Anpassung der Therapie ermöglichen.
Ein 56-jähriger Patient litt an einer seltenen Form von Bauchspeicheldrüsenkrebs. Drei Chemotherapien brachten keinen Erfolg, wie radiologische Bildgebung und Blutuntersuchungen aber auch seine Smartwatch zeigten. Jeder Therapiewechsel ging mit einer Abnahme der Schrittzahl einher, was den zunehmenden Einfluss der Krankheit und der Nebenwirkungen der Behandlung widerspiegelte.
Mit Hilfe einer molekulargenetischen Untersuchung konnte das Team unseres Molekularen Tumorboards eine Veränderung im Erbgut der Tumorzellen nachweisen. Diese sogenannte RET-Gen-Fusion stimuliert das Wachstum der Tumorzellen. Seit 2024 ist der RET-Inhibitor Selpercatinib von der Europäischen Arzneimittelagentur als Monotherapie für Patientinnen und Patienten mit entsprechend genetisch veränderten Tumoren zugelassen. Die Zulassung basiert auf den Ergebnissen der laufenden Phase-I/II-Studie LIBRETTO-001, an der auch das Comprehensive Cancer Center MF beteiligt ist. Und eben in diese Studie konnte der Patient erfolgreich eingeschlossen werden.
Bereits wenige Tage nach Beginn der Therapie spürte der Patient eine deutliche Besserung. Die tastbaren Lymphknoten und Weichteilmetastasen waren geschrumpft, er benötigte weniger Morphium und keine Gehhilfe mehr. Das Monitoring mit der Smartwatch unterstrich den Einfluss von Selpercatinib auf die deutlich verbesserte Lebensqualität und bestätigte die Wirksamkeit der Therapie durch verbesserte körperliche Leistungsindikatoren. Die Messung der Schrittzahl und der Herzfrequenz lieferte einen Echtzeit-Einblick in das Aktivitätsniveau und die physiologischen Reaktionen des Patienten. Diese frühzeitige Erkennung von Verbesserungen ermöglichte eine präzise Anpassung der Therapie, noch bevor herkömmliche Tests Veränderungen zeigten. Ein beeindruckendes Beispiel für die Zukunft der personalisierten Medizin.
Barbara Deschler-Baier*, Markus Krebs*, Matthias Kroiss, Manik Chatterjee, Daniel Gundel, Christian Kestler, Alexander Kerscher, Volker Kunzmann, Silke Appenzeller, Katja Maurus, Andreas Rosenwald, Ralf Bargou, Elena Gerhard-Hartmann & Vivek Venkataramani. Rapid response to selpercatinib in RET fusion positive pancreatic neuroendocrine carcinoma confirmed by smartwatch. npj Precision Oncology 8, 167 (2024). doi:10.1038/s41698-024-00659-x
* geteilte Erstautorenschaft