
Da die Erkrankung oft schon bei Erstdiagnose nicht operabel ist, beginnt die Behandlung meist mit einer Kombination aus Chemotherapie und Immuntherapie, oft ergänzt durch Strahlentherapie. Wegen der schnellen Zellteilung kehrt die Krebserkrankung jedoch häufig rasch zurück, und die Prognose für rezidivierte Fälle ist schlecht.
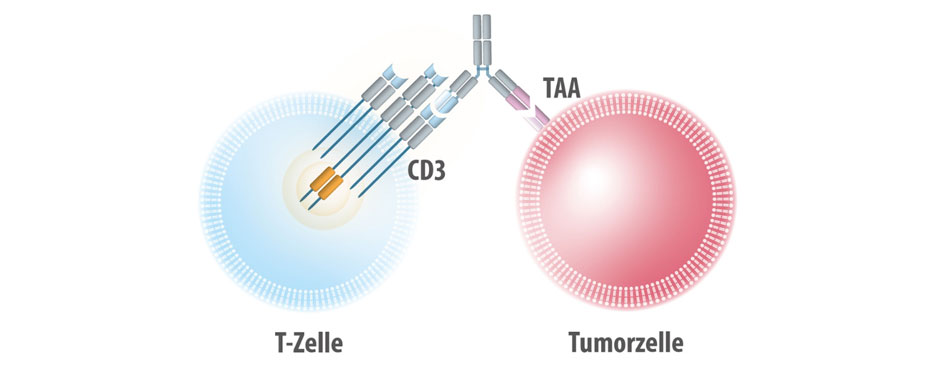
Ein vielversprechender Ansatz ist der bispezifische T-Zell-Engager (BiTE®) Tarlatamab, der gegen das Protein Delta-like Ligand 3 (DLL3) gerichtet ist, das auf SCLC-Zellen stark überexprimiert wird, jedoch kaum auf gesundem Gewebe vorkommt. Durch seine bispezifische Struktur bindet Tarlatamab zusätzlich an T-Zellen und bringt sie in die Nähe der Tumorzellen, um diese zu zerstören. In den Phase-I- und Phase-II-Studien DeLLphi-300 und DeLLphi-301 zeigte Tarlatamab bei vorbehandelten SCLC-Patientinnen und -Patienten eine anhaltende Anti-Tumor-Wirkung und ein kontrollierbares Sicherheitsprofil.
Die verlängerte Nachbeobachtung der Phase-I-Studie, die jetzt als „Clinical Trial Update“ im Journal of Clinical Oncology unter der gemeinsamen Federführung des Comprehensive Cancer Center (CCC) Mainfranken und des Seidman Cancer Center der US-Universitätsklinik Cleveland veröffentlicht wurde, ergab eine mittlere Überlebenszeit von 17,5 Monaten. Auf Basis dieser Daten wurde Tarlatamab in den USA bereits zur Behandlung von rezidiviertem SCLC zugelassen.
Hier geht es zur vollständigen Pressemitteilung mit Kommentaren vom Erstautor, Dr. Horst-Dieter Hummel, Clinician Scientist in der Early Clinical Trial Unit (ECTU) am Interdisziplinären Studienzentrum (ISZ) des CCC Mainfranken und Zentrumsmanager des Nationalen Netzwerks Genomische Medizin Lungenkrebs (nNGM) am UKW.
Afshin Dowlati*, Horst-Dieter Hummel*, Stephane Champiat, Maria Eugenia Olmedo, Michael Boyer, Kai He, Neeltje Steeghs, Hiroki Izumi, Melissa L. Johnson, Tatsuya Yoshida, Hasna Bouchaab, Hossein Borghaei, Enriqueta Felip, Philipp J. Jost, Shirish Gadgeel, Xi Chen, Youfei Yu, Pablo Martinez, Amanda Parkes, Luis Paz-Ares*. Sustained Clinical Benefit and Intracranial Activity of Tarlatamab in Previously Treated Small Cell Lung Cancer: DeLLphi-300 Trial Update. Journal of Clinical Oncology, 2024. doi:10.1200/JCO.24.00553
*Equal contribution: A.D., H.-D.H., and L.P.-A. contributed equally to this work.