Würzburg. Wenn Magnus Schindehütte auf neuroradiologischen Kongressen seine Forschungsergebnisse vorstellt, ist es immer wieder eine Überraschung, welcher Sektion die Beiträge zugeordnet werden. Denn noch ist sein Forschungsgebiet eine Nische. Die neuroradiologische Forschung der letzten Jahrzehnte habe sich insbesondere auf den Kopf bzw. das zentrale Nervensystem konzentriert, sagt Schindehütte. Er dagegen interessiert sich für die Bildgebung im peripheren Nervensystem, insbesondere der Spinalganglien – kurz DRG für dorsal root ganglia. Das sind Ansammlungen von sensorischen Nervenzellkörpern, die sich an der hinteren (dorsalen) Nervenwurzel befinden, kurz bevor diese in das Rückenmark eintritt. Die Neuronen der DRGs empfangen Reize über ihre peripheren Fortsätze und leiten sie über zentrale Axone an das Rückenmark weiter. Die DRGs spielen also eine zentrale Rolle bei der Weiterleitung von Schmerzsignalen vom peripheren zum zentralen Nervensystem, über das Rückenmark bis ins Gehirn. „Das DRG ist die erste Station im Nervensystem, an der Schmerzreize verarbeitet und weitergeleitet werden – eine Schlüsselstelle für das Verständnis, die Diagnose und die Therapie von Schmerzerkrankungen“, betont Magnus Schindehütte.
Der Clinician Scientist in der Neuroradiologie des Uniklinikums Würzburg (UKW) hat mit einem interdisziplinären Team als Seniorautor eine methodische Studie in der renommierten Fachzeitschrift NeuroImage veröffentlicht. Darin stellen die Forscher ein KI-basiertes Modell zur automatischen Erkennung und Segmentierung von Spinalganglien in MRT-Bildern vor. Diese Innovation erleichtert die Beurteilung der Spinalganglien erheblich und eröffnet neue diagnostische Möglichkeiten, insbesondere in der Schmerzmedizin.
Deep Learning Algorithmus segmentiert die Region of Interest (ROI) robust, schnell und frei von menschlichem Bias
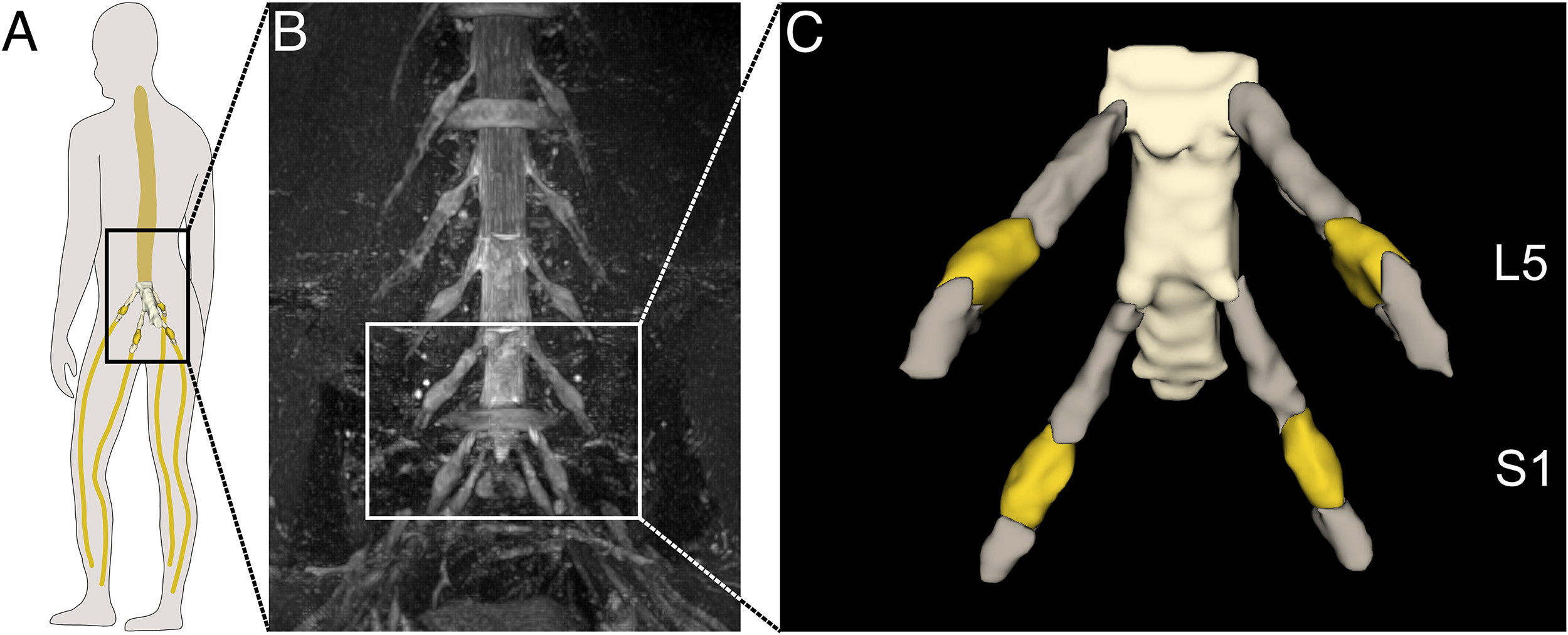
Die Studie konzentrierte sich auf die Spinalganglien der lumbosakralen Rückenmarkssegmente L5 und S1, die im unteren Abschnitt der Wirbelsäule liegen und an der Weiterleitung sensorischer Signale aus den unteren Extremitäten beteiligt sind.
„Was früher oft als unscheinbare Knubbel an der Wirbelsäule abgetan wurde, rückt heute – dank großer Fortschritte in der Bildgebung – immer mehr in den Fokus der Wissenschaft. Die DRGs sind zwar immer noch schwer zu erfassen, weil sie sich mit jeder Atembewegung leicht verschieben, aber die Aufnahmen sind inzwischen so hochauflösend, dass man die Strukturen viel klarer abgrenzen kann“, erklärt Schindehütte.
Die MRT-Aufnahmen seines Teams erreichen eine isotrope Auflösung von 1 × 1 × 1 mm – jedes sogenannte Voxel, also ein dreidimensionaler Bildpunkt, entspricht dabei einem Würfel mit jeweils einem Millimeter Kantenlänge. Um das KI-Modell zu trainieren, markierten Schindehütte und sein Team die Voxel, die sie den Nervenstrukturen zuordneten, manuell mit einem Grafiktablett – eine aufwendige, aber notwendige Vorarbeit für den Deep Learning Algorithmus.
Es sei gar nicht so einfach, die Spinalganglien – die Schaltzentralen der sensorischen Nervenbahnen – von der „Autobahn“ der vorbeiziehenden Nervenfasern abzugrenzen, erklärt Schindehütte. Die so genannte Region of Interest (ROI) sieht bei jedem Menschen etwas anders aus, was die Segmentierung zusätzlich erschwert. Jedes Bild wurde deshalb von drei Experten manuell annotiert. Aus ihren Bewertungen entstand eine Referenz, eine sogenannte Ground Truth, mit der das neuronale Netz trainiert wurde – immer und immer wieder.
Mit Erfolg: Inzwischen erkennt und segmentiert der Deep Learning Algorithmus (nnU-Net) nicht nur die ursprünglichen Trainingsdaten, sondern auch neue MRT-Bilder - und zwar sowohl von gesunden als auch von erkrankten Personen. Dabei arbeitet das System robust, schnell und weitgehend standardisiert – eine wichtige Grundlage für eine objektive und reproduzierbare Diagnostik.
Segmentierung ermöglicht Volumen- und Signalauswertung der DRGs
Ein wichtiger diagnostischer Aspekt ist die Signalintensität der Spinalganglien – also wie hell oder dunkel sie in bestimmten MRT-Sequenzen erscheinen. Bei der Multisystemerkrankung Morbus Fabry zum Beispiel zeigen die DRGs in flüssigkeitssensitiven, sogenannten T2-gewichteten Aufnahmen eine erhöhte Signalintensität – ein Muster, das der KI-Algorithmus zuverlässig erkannte.
Eine mögliche Hypothese: Abbauprodukte, die sich bei Fabry-Patienten im Gewebe anreichern, lagern sich auch in den DRGs ab. Im Zellmodell konnten solche Ablagerungen bereits nachgewiesen werden.
Darüber hinaus können auch Volumenveränderungen – etwa Atrophien – die Spinalganglien betreffen. In einer weiteren Arbeit zeigte Magnus Schindehütte gemeinsam mit einem Team vom Zentrum für Interdisziplinäre Schmerzforschung (ZIS), dass das Spinalganglion, das die Zellkörper jener Nerven enthält, die die Leistenregion versorgen, bei chronischen postoperativen Leistenschmerzen deutlich schrumpft.
Clinician Scientist in KFO5001 ResolvePAIN
Gerade für die Schmerzforschung sind Fortschritte in der Bildgebung der Spinalganglien und deren automatisierte Auswertung von großer Bedeutung. Daher wird Magnus Schindehütte im Rahmen des Clinician Scientist Programms vom Interdisziplinären Zentrum für Klinische Forschung (IZKF) gefördert. Diese Förderung ist in seinem Fall eingebettet in die Klinische Forschungsgruppe KFO5001 ResolvePAIN am UKW, die von Prof. Dr. Heike Rittner und Prof. Dr. Claudia Sommer geleitet wird.
Diese Förderung ermöglicht es ihm, neben seiner Facharztausbildung kontinuierlich an seiner Forschung zu arbeiten. Nachdem er sich zunächst mit morphologischen Parametern wie Größe und Signalintensität beschäftigt hat, interessieren ihn nun zunehmend funktionelle Fragestellungen: Wie verarbeiten die DRGs Schmerzreize? Was passiert bei der Schmerzentstehung – und was bei der Linderung?
„Schmerz ist immer subjektiv. Wir versuchen, ihn bildgebend zu erfassen und damit einen Surrogatmarker für die Schmerzverarbeitung zu identifizieren. Wenn wir verstehen, was physiologisch im DRG passiert, können wir künftig gezielter über therapeutische Ansätze nachdenken“, erklärt Magnus Schindehütte.
Als Seniorautor der Studie lieferte er gemeinsam mit dem Team der Neuroradiologie die klinische und bildgebende Expertise. Für die technische Umsetzung sorgte das Biozentrum der Julius-Maximilians-Universität Würzburg (Center for Computational and Theoretical Biology, CCTB) – allen voran Dr. Philip Kollmannsberger und Aliya C. Nauroth-Kreß als Erstautorin.
Erste Schritte zu einer breiteren Anwendung
„Unser Methodenpapier zeigt, dass es einen wissenschaftlichen Bedarf für eine objektive Auswertung der Spinalganglien gibt“, sagt Magnus Schindehütte. „Unser trainiertes Netz ist frei zugänglich und kann anderen Zentren helfen, standardisierte Auswertungen durchzuführen – auch international. Damit schaffen wir die Grundlage für eine verlässliche Vergleichbarkeit zwischen verschiedenen Einrichtungen und Studien – und einen weiteren Beleg dafür, dass in der Neuroradiologie die Musik nicht nur im Kopf, sondern auch im peripheren Nervensystem spielt.“
Text: KL / Wissenschaftskommunikation
Publikation:
Aliya C. Nauroth-Kreß, Simon Weiner, Lea Hölzli, Thomas Kampf, György A. Homola, Mirko Pham, Philip Kollmannsberger, Magnus Schindehütte. Automated segmentation of the dorsal root ganglia in MRI. NeuroImage, Volume 311, 2025, 121189. ISSN: 1053-8119. doi.org/10.1016/j.neuroimage.2025.121189