CAR-Technologie
Aufbau, Funktion und Anwendung von CAR-T-Zellen
Was sind CAR-T-Zellen?
Bei der CAR-T-Zell-Therapie werden T-Zellen – eine bestimmte Art Immunzellen – aus dem Blut der Patientin oder des Patienten gesammelt und im Labor genetisch verändert und vermehrt. Anschließend werden sie der Patientin oder dem Patienten als Infusion wieder verabreicht.
Durch die Modifikation bilden die T-Zellen an der Oberfläche sogenannte CARs aus, wobei CAR für chimärer Antigen-Rezeptor steht. Diese Rezeptoren versetzen die Immunzellen in die Lage, für Krebszellen charakteristische Oberflächenmoleküle zu erkennen. Entdecken die CAR-T-Zellen ein solches Molekül, greifen sie die Krebszellen an und vermehren sich. Eine einzige T-Zelle kann auf diesem Weg zur Zerstörung von 1000 Tumorzellen führen. Idealerweise verbleiben die T-Zellen ein Leben lang im Körper und schalten versteckte oder neu aufgetretene Tumorzellen aus.
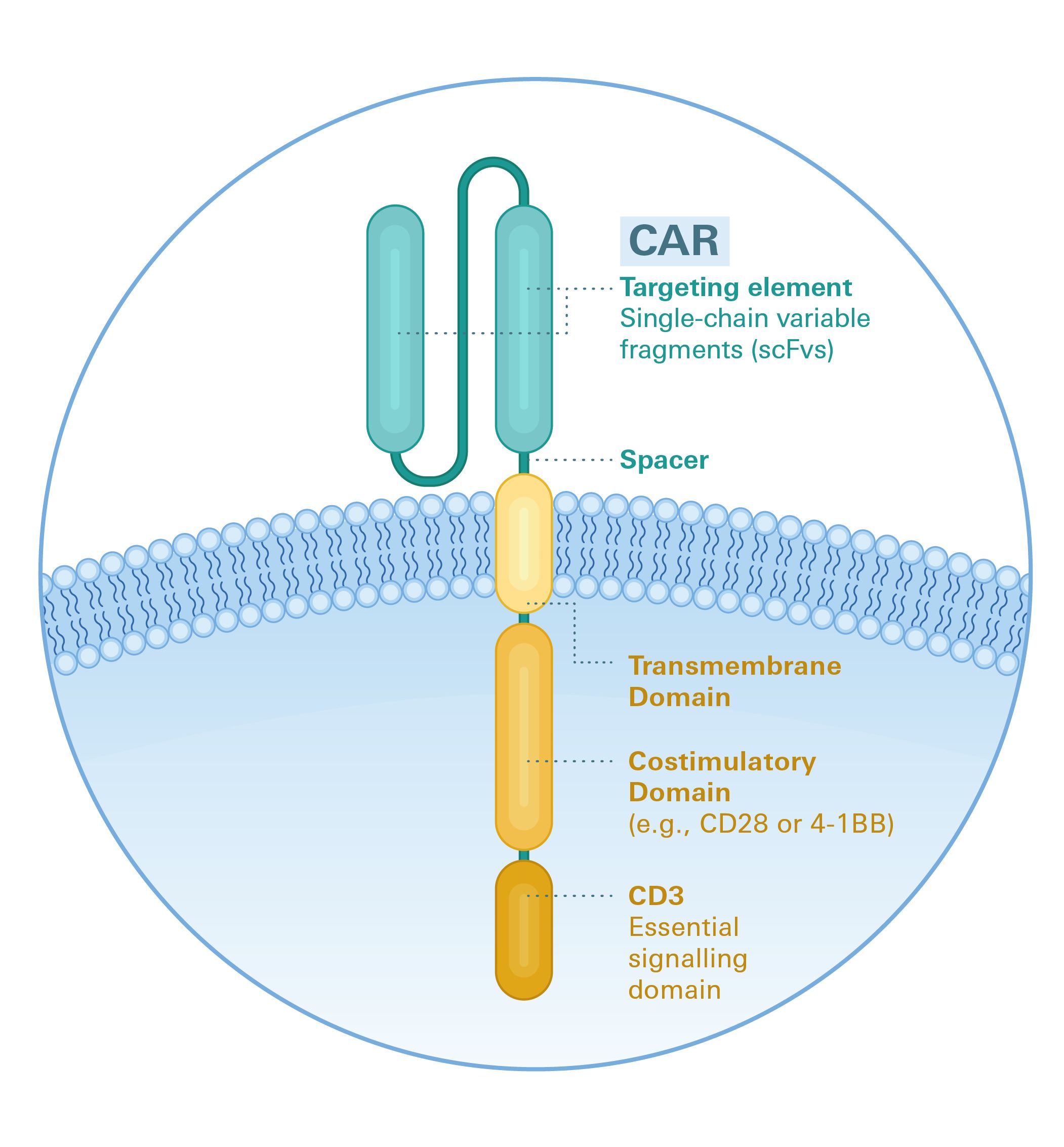
CARs sind synthetische Rezeptoren und bestehen aus:
- einer extrazellulären Antigen-bindenden Domäne, die von den variablen schweren und leichten Ketten eines monoklonalen Antikörpers abgeleitet ist
- einer Spacer- und Transmembran-Domäne, die den Rezeptor auf der Oberfläche einer T-Zelle verankert
- einem intrazellulären Signalmodul, meist CD3-Zeta, und einer oder mehreren kostimulatorischen Domänen, die die Aktivierung der T-Zelle nach der Antigenbindung vermitteln.
Was ist die Funktion von CAR-T-Zellen?
CARs lenken T-Zellen so um, dass sie Tumorzellen erkennen. Sie binden an Oberflächenmoleküle, die auf Tumorzellen unabhängig von HLA exprimiert werden. Damit wird die hohe Spezifität eines Antikörpers mit der Wirksamkeit und Dauerhaftigkeit einer zellulären Immunantwort kombiniert.
Wofür werden CAR-T-Zellen verwendet?
CAR-T-Zellen werden für die Krebsbekämpfung entwickelt. CD19-spezifische CAR-T-Zellen wurden vor kurzem für die Behandlung von B-Zell-Malignomen bei Kindern und Erwachsenen zugelassen. Zudem laufen an Krebszentren weltweit klinische Studien an Patientinnen und Patienten mit anderen Malignomen. Dabei wird das Potenzial von T-Zellen, die CARs exprimieren, gegen eine Vielzahl von Zielen untersucht.
Wie werden CAR-T-Zellen entworfen?
Die Konzeption und das Design von CARs erfolgt mithilfe einer speziellen Software. Die genetische Information, die für die CAR kodiert, wird entweder durch viralen oder nicht-viralen Gentransfer in die T-Zellen eingebracht, zum Beispiel mithilfe eines Elektroporators.
Anschließend wird eine Reihe von Experimenten durchgeführt, um die Funktionalität der manipulierten CAR-T-Zellen zu testen. Diese Funktionsanalyse umfasst die Lyse von Tumorzellen, die Sekretion von Zytokinen und die Proliferation von T-Zellen.
Klinische Anwendung von CAR-T-Zellen
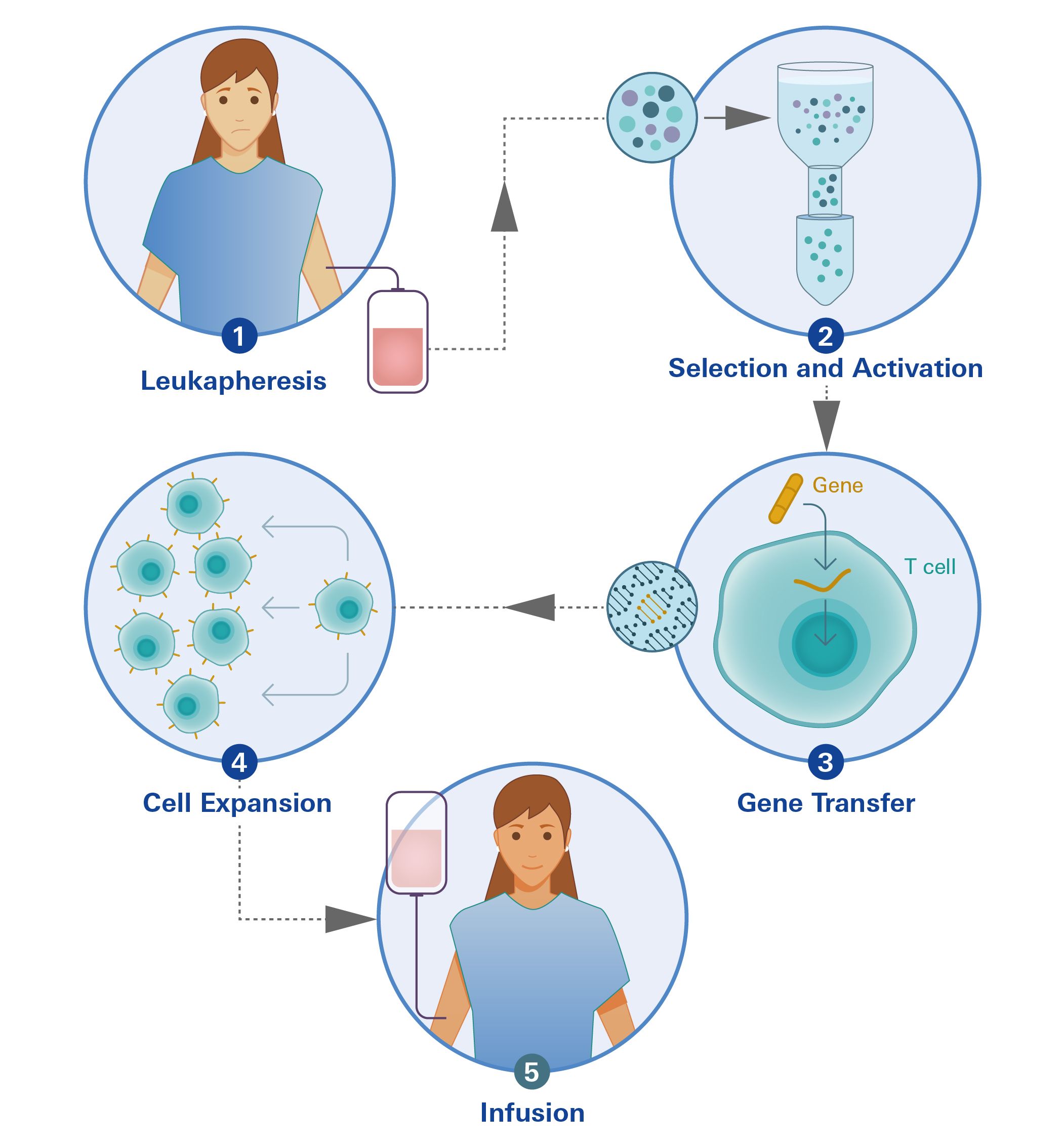
Zur Herstellung therapeutischer CAR-T-Zellen werden die weißen Blutkörperchen eines Patienten in einem als Leukapherese bezeichneten Verfahren entnommen (1). Die Probe wird von den entsprechenden T-Zellen getrennt oder angereichert (2), die Gensequenz für das CAR-Konstrukt wird in die DNA der T-Zellen eingefügt (3), und die modifizierten T-Zellen werden ex-vivo expandiert (4). Die Zellen können dann dem Patienten wieder infundiert werden (5). Nach der Infusion sind die modifizierten T-Zellen darauf ausgelegt, sich zu vermehren, wenn sie auf die Zielproteine treffen, und die anvisierten Krebszellen zu töten. Darüber hinaus können CAR-T-Zellen mit Gedächtnisfunktion ein Wiederauftreten der Krankheit verhindern.
Das Universitätsklinikum Würzburg gehört mit dem Lehrstuhl für Zelluläre Immuntherapie zu einer Gruppe ausgewiesener Zentren in Europa und weltweit, die eigene CAR-T-Zellprodukte in klinischen Studien überführt und anwendet.