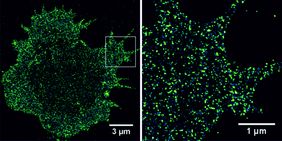
„Die Krebszellen des Multiplen Myeloms können auf ihrer Oberfläche das Antigen CD19 tragen und von Designer-T-Zellen, die das CD19-Molekül spezifisch erkennen, auch vernichtet werden“ berichtet Dr. Michael Hudecek, Krebsforscher der Medizinischen Klinik II des Uniklinikums Würzburg (UKW). Das ist die zentrale Erkenntnis einer aktuellen Studie, die die Würzburger Mediziner in Zusammenarbeit mit den Biophysikern der Universität durchgeführt und im Juli dieses Jahres in der Fachzeitschrift Nature Communications veröffentlicht haben.
T-Zellen sind weiße Blutkörperchen, die der Immunabwehr dienen. Leider sind sie in ihrem natürlichen Zustand gegenüber Tumorzellen fast „blind“. Durch gentechnologische Veränderungen können sie jedoch für jeweils eine spezifische Krebsart maßgeschneidert „scharfgestellt“ werden. Dazu werden sie mit einem künstlichen (chimären) Antigenrezeptor (CAR) ausgestattet. Mit diesem sind sie in der Lage, Tumorzellen, die das Zielmoleküle CD19 tragen, zu erkennen und zu zerstören. „Diese Therapie funktioniert bei Patienten mit CD19-positiver Leukämie und Lymphknotenkrebs bereits sehr gut und es gibt erste Erfahrungsberichte bei Patienten mit Multiplem Myelom. Die positiven Erfahrungsberichte mit der CD19-CAR-T-Zelltherapie bei Patienten mit Multiplem Myelom sorgten in der Fachwelt für große Aufmerksamkeit, denn mit herkömmlichen Analyseverfahren ist das CD19-Molekül auf den Myelomzellen praktisch nicht nachweisbar“, schildert Dr. Thomas Nerreter aus der Arbeitsgruppe von Dr. Hudecek und fährt fort: „Wir haben in dem aktuellen Projekt deshalb erstmals einzelmolekülempfindliche Super-Resolution-Mikroskopieverfahren eingesetzt, um gezielt nach dem CD19-Molekül zu suchen – und sind in der Tat auch fündig geworden.“
Auflösung auf Einzelmolekülebene
Um die ablaufenden Prozesse und letztlich auch die Empfindlichkeitsschwelle der CD19-CAR-T-Zellen besser beurteilen zu können, kooperierten die UKW-Forscher mit dem Lehrstuhl für Biotechnologie und Biophysik der Julius-Maximilians-Universität Würzburg. Lehrstuhlinhaber Prof. Dr. Markus Sauer erläutert: „Wir haben eine Fluoreszenzmikroskopietechnik entwickelt, die es uns ermöglicht, einzelne Moleküle mit einer räumlichen Auflösung von 20 Nanometern abzubilden. Mit dieser sogenannten dSTORM-Technologie ist es möglich, die Antigen-Expression auf Zellen direkt und quantitativ nachzuweisen.“
In dem gemeinsamen Forschungsprojekt wurden Proben von Myelom-Patienten der Medizinischen Klinik II des UKW per dSTORM untersucht. „Während bei klassischen Detektionsmethoden für einen sicheren Nachweis rund 1.500 Moleküle des Antigens auf einer Zelle vorhanden sein müssen, reichten uns im Bestfall 13 Moleküle“, verdeutlicht Sebastian Letschert vom Lehrstuhl für Biotechnologie und Biophysik den drastischen Sprung in der Detailschärfe.
CAR-T-Zellen sprechen schon auf geringe CD19-Mengen an
„Mit Hilfe der superauflösenden Mikroskopie konnten wir zeigen, dass das CD19-Antigen tatsächlich deutlich häufiger auf Myelom-Zellen zu finden ist, als das mit klassischen Detektionsmethoden erkennbar war“, resümiert Dr. Nerreter und fährt fort: „Schon diese geringen Antigen-Mengen reichen offenbar aus, um die Tumorzellen für die CAR-T-Zellen identifizierbar zu machen.“
Es wurde jedoch auch deutlich, dass es Myelom-Zellen gibt, auf denen keine CD19-Antigene nachgewiesen werden konnten. „Wir gehen deshalb davon aus, dass eine Immuntherapie mit CD19-CAR-T-Zellen dann am wirksamsten ist, wenn sie noch mit anderen Myelom-wirksamen Substanzen kombiniert wird. Eine weitere Möglichkeit ist es, CAR-T-Zellen herzustellen, die mehrere Antigene gleichzeitig erkennen, einerseits um die Wirksamkeit und andererseits um die Trennschärfe gegenüber normalen Blutzellen noch weiter zu erhöhen“, sagt Prof. Dr. Hermann Einsele, der Direktor der Medizinischen Klinik II des UKW.
Literatur:
Nerreter, T, Letschert, S, Doose, S, Danhof, S, Einsele, H, Sauer*, M, Hudecek*, M (2019). Super-resolution microscopy reveals ultra-low CD19 expression on myeloma cells that triggers elimination by CD19 CAR-T. , Nat Communications 10, 3137. /doi.org/10.1038/s41467-019-10948-