Würzburg. Ein bisschen Fett ist ok. Wenn die Leber als zentrales Organ des Kohlenhydrat- und Fettstoffwechsels aber mehr Fett speichern muss, als sie abbauen kann, spricht man von einer Fettleber. 30 Prozent der modernen Bevölkerung sind von dieser sogenannten Steatose betroffen. „Und mit der Zahl der Übergewichtigen steigt die Zahl unserer Patientinnen und Patienten“, warnt Prof. Dr. Andreas Geier, Leiter der Hepatologie am Universitätsklinikum Würzburg (UKW). Jeder Fünfte mit einer Fettleber erkrankt an einer Fettleberhepatitis. Die Entzündung kann zu schweren Vernarbungen - Fibrose und Zirrhose - sowie zu Krebs führen. Doch nicht nur Umweltfaktoren wie Überernährung und Bewegungsmangel, sondern auch genetische Veranlagungen können eine Fettleber verursachen.
DNA von 10.000 alten und modernen Menschen analysiert
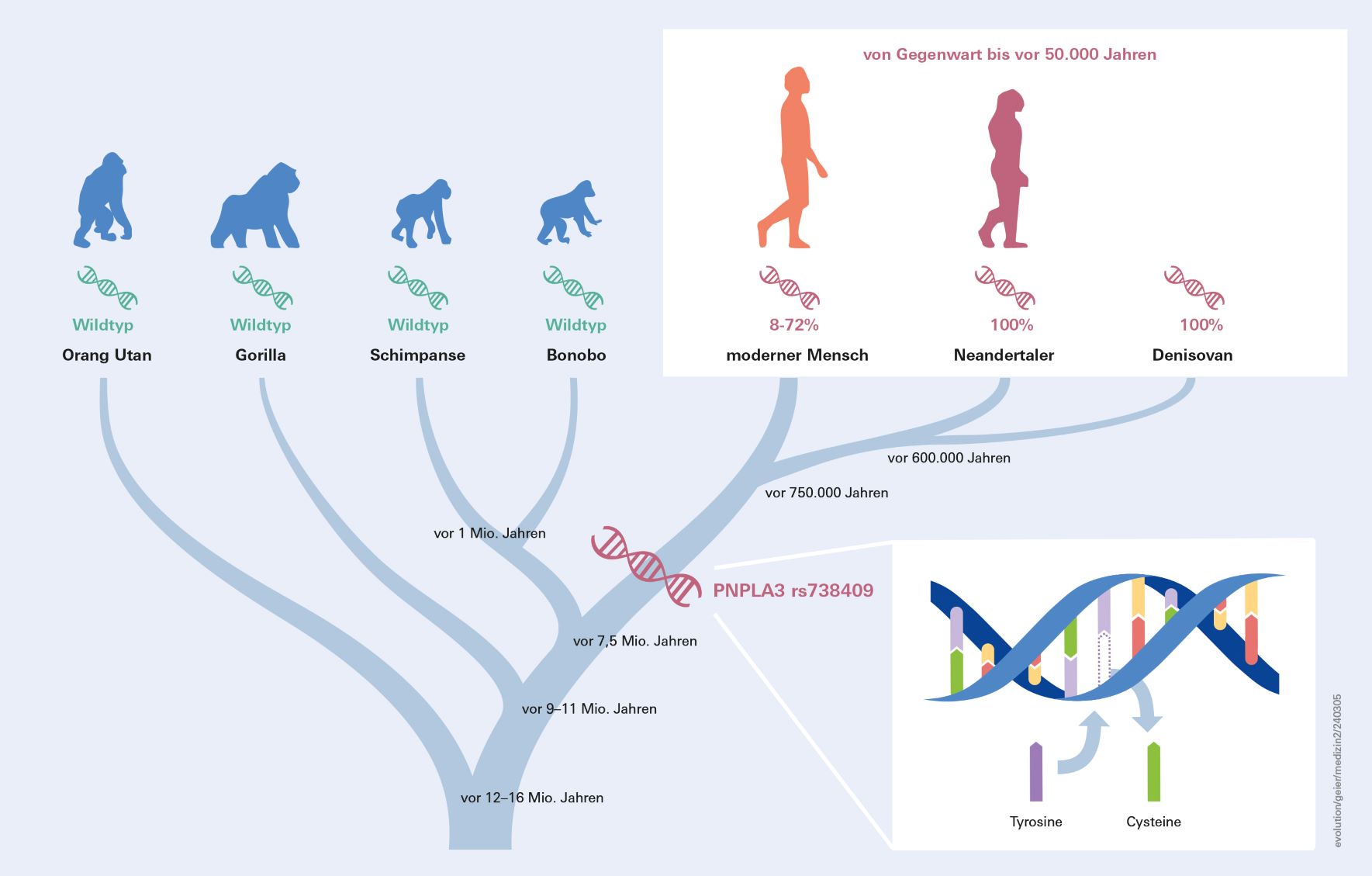
Eine bekannte und relevante Rolle bei der Entwicklung einer Fettlebererkrankung spielt die häufige Variante rs738409 des PNPLA3-Gens (siehe Infokasten). Während die Variante in afrikanischen Ländern eher selten auftritt - in Kenia liegt die Häufigkeit bei 8 Prozent - tragen in Mesoamerika rund 70 Prozent das Risiko-Allel, Spitzenreiter ist Peru mit 72 Prozent. Wie kommt es zu dieser auffallend heterogenen globalen Präsenz des Risiko-Allels? Wo liegt der Ursprung der PNPLA3-Variante rs738409? Diese Fragen beschäftigten den anthroplogisch interessierten Andreas Geier schon länger. Er kontaktierte Prof. Dr. Svante Pääbo vom Max-Planck-Institut für evolutionäre Anthropologie in Leipzig (MPI-EVA), der im Jahr 2022 für die Sequenzierung des Genoms der Neandertaler mit dem Nobelpreis ausgezeichnet wurde. Pääbo stellte den Kontakt zur Abteilung Archäogenetik her, deren Direktor, Prof. Dr. Johannes Krause, der erste genetische Nachweis eines Denisova-Menschen gelang. Der Denisova-Mensch lebte vor rund 40.000 Jahren im sibirischen Altai-Gebirge und gilt neben Homo sapiens und Neandertaler als dritte Population der Gattung Homo.
Gemeinsam mit Stephan Schiffels, Leiter der Arbeitsgruppe Populationsgenetik am MPI-EVA, Prof. Dr. Marcin Krawczyk vom UKS und seinem Doktoranden Jonas Trost analysierte Andreas Geier die DNA von mehr als 10.000 archaischen und modernen Menschen aus aller Welt. Darunter sind alle 21 verfügbaren Neandertaler-Genome und zwei Denisovaner-Genome sowie der weltweit einzige Hybrid, das Urzeit-Kind mit einer Neandertaler-Mutter und einem Denisovan-Vater.
Primaten tragen Wildtyp, Frühmenschen 100 % Risiko-Allel
„Überraschenderweise trugen alle archaischen Menschen, die vor 40.000 bis 65.000 Jahren lebten, ausschließlich das Risiko-Allel, was auf eine Fixierung des Varianten-Allels bei ihren gemeinsamen Vorfahren hindeutet“, erklärt Andreas Geier und geht im menschlichen Stammbaum noch weiter zurück. „Bei der Analyse der Referenzgenomsequenz von Primaten wurde deutlich, dass die Menschenaffen, vom Orang-Utan über Gorilla bis zum Schimpansen und Bonobo, eine ursprüngliche, weniger riskante Genvariante tragen, einen sogenannten Wildtyp.“
Fettspeicherung sicherte einst das Überleben
Daraus schließen die Wissenschaftler, dass die Hauptvariante des Fettleber-Gens PNPLA3 bereits vor der Aufspaltung des menschlichen Stammbaums vor mehr als 700.000 Jahren entstanden sein muss (siehe Abbildung 1). Aber warum? Schließlich hat diese Variante ungünstige Auswirkungen auf die menschliche Gesundheit. Eine Hypothese ist, dass diese und andere Genvarianten, die am Stoffwechsel beteiligt sind, in der Altsteinzeit, dem Paläolithikum, entwickelt wurden, um das Überleben zu sichern. „Insbesondere die Fähigkeit, Fett zu speichern, war wahrscheinlich während des größten Teils der Menschheitsgeschichte von Vorteil, während sie unter den heutigen Lebensbedingungen von Nachteil ist“, erklärt Andreas Geier und zieht zum Vergleich den Habitus von Gänsen heran, die sich vor Langstreckenflügen eine Fettleber anfressen, um genügend Energie an Bord zu haben.
Unterstützt PNPLA3 die Thermogenese?
PNPLA3 wird auch in der Netzhaut exprimiert. Hier ist es am Stoffwechsel von Vitamin A beteiligt, das das Sehen in der Dämmerung beeinflusst – möglicherweise ein wichtiger Aspekt bei der Jagd. Außerdem kommt es im braunen Fettgewebe vor. „Unsere Beobachtung könnte den Vorteil der Fettspeicherung in kaltem Klima und insbesondere für Neandertaler unter eiszeitlichen Bedingungen unterstreichen“, spekuliert Geier. Für diese Hypothese spricht, dass die PNPLA3-Variante bei 89,3 Prozent der Jakuten-Bevölkerung in der kältesten Region im Nordosten Russlands vorherrscht. Weitere Untersuchungen zur Funktion von PNPLA3 bei der Wärmeproduktion außerhalb der Leber wären laut Geier spannend.
Kein signifikantes Signal für natürliche negative Selektion
Interessant ist auch die Frage nach der natürlichen Selektion. Die Allelfrequenzen rund um den Globus haben sich in den vergangenen 15.000 Jahren kaum verändert. Es gibt im archäogenetischen Datensatz keinen signifikanten Hinweis auf genetische Selektion. Spricht das nicht gegen die Hypothese der natürlichen Selektion im Paläolithikum? Stephan Schiffels rät zur Vorsicht: „Obwohl unsere genomweite Analyse keine signifikanten Signale für natürliche Selektion in den letzten 10.000 Jahren gefunden hat, besteht immer noch die Möglichkeit, dass Selektion in Zeiträumen aktiv war, die älter sind als die, die wir heute statistisch analysieren können“. Angesichts der begrenzten Lebensspanne archaischer Menschen sei es auch nicht überraschend, dass kein Signal in Richtung negativer Selektion gefunden werden konnte, da diese Variante ihre ungünstigen Auswirkungen wahrscheinlich erst im späteren Erwachsenenalter entfaltet und daher weniger wahrscheinlich die Fortpflanzungsdynamik beeinflusst.
Haben wir das Fettleber-Gen von den Neandertalern geerbt?
Ob wir Menschen die PNPLA3-Variante rs738409 von den Neandertalern geerbt haben, ist laut Andreas Geier die naheliegendste Frage, die sich aus der Studie ergibt, und sie ist nicht ganz unbegründet. So wurde die Genvariante SLC16A11, die unter anderem zu Diabetes Mellitus führt, von den Neandertalern auf die modernen Menschen übertragen, aber nicht an alle. Der Homo neanderthalensis lebte bereits in Europa als der Homo sapiens aus Afrika kam und ein Genaustausch stattfand. In Afrika findet man SLC16A11 nicht, dafür aber Varianten von PNPLA3. Und das spricht gegen einen Gentransfer durch den Neandertaler. „Obwohl er dazu beigetragen haben könnte“, fügt Stephan Schiffels hinzu. „Tatsächlich zeigen unsere nachfolgenden Analysen, dass eines von 1.000 heutigen PNPLA3-Varianten-Allelen aus dem Neandertaler-Genom stammen könnte.“
Förderung und Publikation:
Die mit finanzieller Unterstützung des European Research Council (ERC) im EU-Forschungsrahmenprogramm Horizon 2020 (grant agreement number 851511) gewonnenen Erkenntnisse wurden im renommierten Fachjournal für Gastroenterologie und Hepatologie Gut publiziert: Andreas Geier, Jonas Trost, Ke Wang, Clemens Schmid, Marcin Krawczyk, Stephan Schiffels: PNPLA3 fatty liver risk allele was fixed in Neanderthals and segregates neutrally in humans. Gut. Published Online First: 08 March 2024. doi: 10.1136/gutjnl-2023-331594
Das PNPLA3-Gen ist für die Produktion eines Enzyms namens Patatin-like Phospholipase Domain-containing Protein 3 (PNPLA3) verantwortlich. Das Enzym ist an Prozessen beteiligt, die die Speicherung und Freisetzung von Fetten regulieren. Mutationen oder genetische Varianten im PNPLA3-Gen können die Aktivität dieses Enzyms beeinflussen und damit den Fettstoffwechsel in der Leber verändern. So ist ein bestimmter genetischer Polymorphismus mit dem Referenzmarker rs738409 im PNPLA3-Gen mit einem erhöhten Risiko für eine Fettlebererkrankung assoziiert. Diese Variationen können dazu führen, dass die Leber mehr Fett speichert und weniger effizient abbaut, was zu einer Fettansammlung in der Leber führt und das Risiko für Lebererkrankungen erhöht.