Würzburg. Fabian ist das zweihundertste MIAI-Baby. Mit ihm hat die MIAI-Studienambulanz des Universitätsklinikums Würzburg (UKW) einen wichtigen Meilenstein erreicht, um schon einige der Fragestellungen eines von der Deutschen Forschungsgemeinschaft (DFG) geförderten Projektes anzugehen. Mit den in der MIAI-Geburtskohorte gesammelten Daten, Untersuchungsergebnissen und Bioproben will das Studienteam um Prof. Dr. Dorothee Viemann verstehen, wie Babys im ersten Lebensjahr lernen, sich gegen Viren wie Influenza, RSV oder SARS-CoV-2 zu verteidigen. MIAI steht für Maturation of Immunity Against Influenza - die Entwicklung des Immunsystems gegen Virusinfektionen der Atemwege. Virale Atemwegsinfektionen sind nach wie vor weltweit ein großes Problem und verursachen zahlreiche Erkrankungen und Todesfälle.
Welche Einflüsse prägen das Immunsystem?
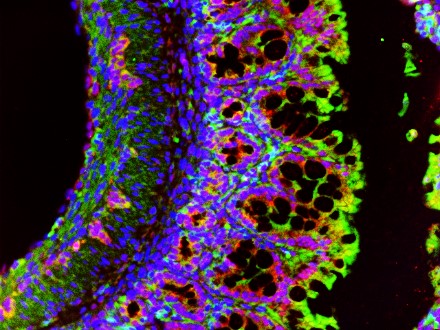
Nach der Geburt reift das Immunsystem und passt sich der neuen Umwelt an. Wie gut sich unser Immunsystem zur Abwehr solche Virusinfektionen entwickelt, hängt neben genetischen Faktoren vor allem von Umwelteinflüssen ab. Welche Umweltfaktoren die Immunreifung fördern und welche sie stören, ist allerdings bis heute nicht ganz klar. Zudem gilt es zu verstehen, welche Komponenten und Zellen des Immunsystems bei Neugeborenen und Kindern wichtig sind, um schwere Atemwegsinfektionen zu verhindern. Diese Unklarheiten nimmt der Lehrstuhl für Translationale Pädiatrie der Kinderklinik gemeinsam mit der Frauenklinik in der MIAI-Studie genauer unter die Lupe.
Das MIAI-Team untersucht zum Beispiel, welche Rolle der sozioökonomische Hintergrund, die Anzahl von Familienmitgliedern, Kinderkrippenbesuche, Impfungen, Infektionen und Ernährung bei der frühen Entwicklung von Immunantworten spielen. Außerdem wird der Frage nachgegangen, ob es einen Zusammenhang zwischen der Bildung des Mikrobioms, also der Gesamtheit der Mikroorganismen im Körper, und der Entwicklung der Immunität gegen diese Virusinfektionen nach der Geburt gibt.
Dazu werden die Kinder direkt nach der Geburt in der Würzburger Frauenklinik sowie nach einem, sechs und zwölf Monaten in der MIAI-Studienambulanz der benachbarten Kinderklinik untersucht. Dabei werden der Gesundheitszustand der Kinder erfragt, verschiedene biologische Proben wie Hautabstriche und Stuhlproben gesammelt, die Babys gemessen und gewogen, Herz und Lunge abgehört und der Muskeltonus überprüft.
MIAI-Kinder liefern wichtigen Beitrag für die Wissenschaft
Die Pläne und das Design der MIAI-Studie sowie die Charakteristika der ersten 171 MIAI-Babys hat Dorothee Viemann jetzt mit ihrem Team in der Fachzeitschrift Frontiers in Immunology veröffentlicht. Besonders hervorzuheben sei die Akzeptanz des Studiendesigns. „Wir haben eine relativ geringe Abbruchquote von etwa 8 Prozent“, berichtet Studienkoordinatorin Dr. Carina Hartmann, die gerade selbst Mutter eines Sohnes geworden ist. Dazu zählen auch Familien, die aus Würzburg weggezogen sind. „Ohne die Eltern könnten wir die MIAI-Studie nicht durchführen. Und die Eltern sind wirklich sehr engagiert, sie kommen gerne zu uns, jetzt auch schon mit den ersten Geschwisterkindern. Das spricht für die Studie und das Studienteam. Unser Studienteam hat zu jedem Kind ein Gesicht und verfolgt seine Entwicklung mit Spannung und Freude.“
Viele Eltern schätzen den zusätzlichen Blick auf ihr Kind neben den U-Untersuchungen beim niedergelassenen Kinderarzt, die Motive für die Teilnahme an der Studie sind aber vor allem altruistischer Natur. Auch Fabians Eltern machen gerne bei MIAI mit, „weil wir mit unseren und Fabians Daten einen wertvollen Beitrag für die Wissenschaft leisten können“. Denn die Ergebnisse könnten helfen, die Immunität gegen Atemwegsviren besser zu verstehen und Empfehlungen zu geben, wie Eltern die Entwicklung des Immunsystems frühzeitig fördern können, um schwere Krankheitsverläufe zu vermeiden.
MIAI-Studie geht weiter – Dank des großen Engagements der Eltern und weiterer Fragestellungen
Viele Erkrankungen werden erst nach der Säuglingszeit sichtbar. Ein frühkindliches Asthma bronchiale ist dafür ein klassisches Beispiel. Häufige Bronchitiden im Laufe des ersten Lebensjahrs können ein Vorläufersymptom für ein Asthma sein, aber nicht bei jedem Kind manifestiert sich tatsächlich diese chronische Atemwegserkrankung. Um solche Zusammenhänge zu verstehen und Faktoren zu identifizieren, die die Entstehung chronisch immunologischer Erkrankungen begünstigen, ist die Nachverfolgung der MIAI-Kinder über das erste Lebensjahr hinaus nun unerlässlich.
Wenn es die finanziellen Möglichkeiten erlauben, würden Prof. Dorothee Viemann und Prof. Christoph Härtel, Direktor der Kinderklinik, gesundheitsrelevante Daten gerne bis über das 16. Lebensjahr hinaus sammeln. „In der Pubertät wird im Immunsystems nochmals vieles neugeordnet und reprogrammiert“ erklärt Dorothee Viemann. „Mit diesem Projekt würden wir den Grundstein für wichtige zukünftige Erkenntnisse legen - eine solche Kohorte wäre gerade für die kommende Generation an Forscherinnen und Forschern ein unglaublicher Schatz!“
Studienwebseite mit weiteren Informationen: www.ukw.de/miai.
Publikation:
Carina R. Hartmann, Robin Khan, Jennifer Schöning, Maximilian Richter, Maike Willers, Sabine Pirr, Julia Heckmann, Johannes Dirks, Henner Morbach, Monika Konrad, Elena Fries, Magdalene Winkler, Johanna Büchel, Silvia Seidenspinner, Jonas Fischer, Claudia Vollmuth, Martin Meinhardt, Janina Marissen, Mirco Schmolke, Sibylle Haid, Thomas Pietschmann, Simona Backes, Lars Dölken, Ulrike Löber, Thomas Keil, Peter U. Heuschmann, Achim Wöckel, Sagar, Thomas Ulas, Sofia K. Forslund-Startceva, Christoph Härtel, Dorothee Viemann. A clinical protocol for a German birth cohort study of the Maturation of Immunity Against respiratory viral Infections (MIAI). Frontiers in Immunology, Volume 15 - 2024, https://doi.org/10.3389/fimmu.2024.1443665
Text: Kirstin Linkamp / UKW