Immundermatologie
AG Schmieder
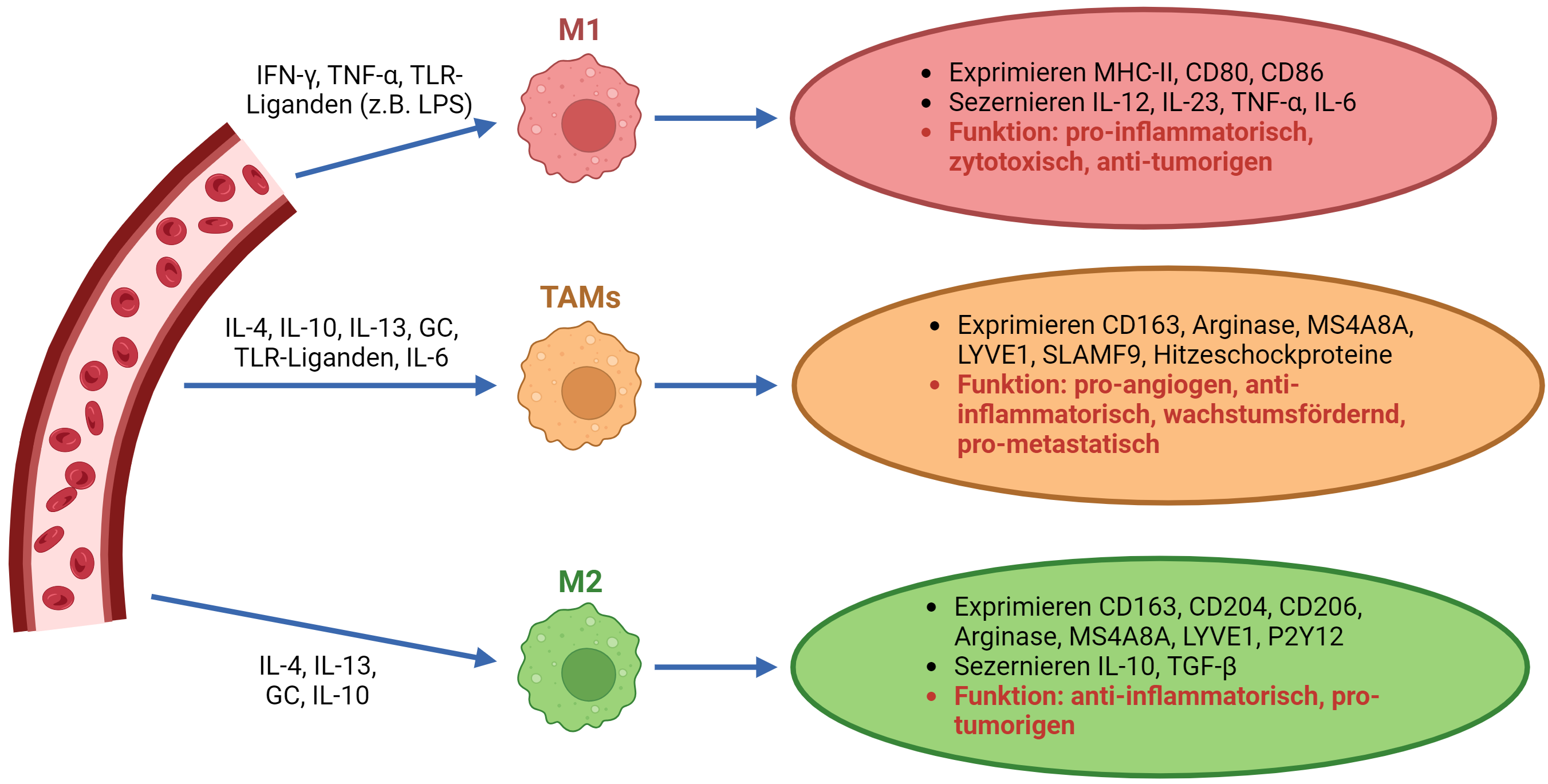
Makrophagen sind zentrale Effektorzellen des angeborenen Immunsystems und spielen bei vielen pathologischen Prozessen eine Rolle. Sie werden vereinfacht in pro-inflammatorische (M1, entzündungsfördernd) und anti-inflammatorische (M2, entzündungshemmend) Makrophagen eingeteilt.
Diese beiden Makrophagen-Phänotypen unterscheiden sich in der Expression ihrer Zelloberflächenmoleküle, den sezernierten Zytokinen und ihren biologischen Funktionen. Es konnte bereits gezeigt werden, dass die jeweiligen M1- und M2-Subtypen reversibel beeinflusst werden können und dies zu einer veränderten Funktionalität der Makrophagen führt. Über welche Signalwege genau diese Veränderungen erreicht werden und welchen Einfluss dies auf Hauterkrankungen hat, ist noch nicht erforscht.
Hautkrebs ist eine der fünf häufigsten Krebsarten weltweit. Sobald Hautkrebs metastasiert, liegt die 5-Jahres-Überlebensrate bei nur 60 Prozent. Neue Behandlungsmethoden wie die sogenannte Immuntherapie verbessern die Prognose von Stadium-IV-Melanom-Patientinnen und -Patienten deutlich. Allerdings sprechen nur 40 bis 50 Prozent der Patientinnen und Patienten auf Immun-Checkpoint-Inhibitoren (ICI) wie Anti-PD-1-Antikörper an. Jede zweite Patientin und jeder zweite Patient zeigt Unverträglichkeiten (severe immune-related adverse events) oder weist eine intrinsische, also natürliche Resistenz gegen diese Therapie auf.
Tumor-assoziierte Makrophagen (TAM) sind unter anderem für die intrinsische Resistenz gegen ICI mitverantwortlich, da diese Zellen das Wachstum und die Metastasierung des Melanoms fördern. Es konnte gezeigt werden, dass die Resistenz gegenüber der PD-1-Immuntherapie mit einer erhöhten Infiltration von M2-ähnlichen TAM einhergeht. In diesem Zusammenhang untersuchen wir die Möglichkeit einer Repolarisation, also eine Anpassung der Zelleigenschaften der M2-ähnlichen TAM in einen proinflammatorischen M1-ähnlichen Phänotyp. Wir erhoffen uns, dadurch neue Einblicke in die Mechanismen der Therapieresistenz zu gewinnen und gleichzeitig neue Therapieansätze zu identifizieren.
In der Arbeitsgruppe Immundermatologie kommen sowohl In-vivo-Modelle als auch primäre In-vitro-Kulturen zum Einsatz, um die zugrundeliegenden Mechanismen zu analysieren. Gängige Methoden wie qRT-PCR, FACS, Western Blot, ELISA und immunochemische Färbungen werden durch moderne Analyseverfahren wie zum Beispiel die KI-basierte Quantifizierung oder Multiplexing ergänzt.
Bewerbungen und Karriere
Wir freuen uns immer über Initiativbewerbungen von motivierten Studierenden und von technischen Assistentinnen und Assistenten.
Bei Interesse senden Sie Ihre aussagekräftigen Bewerbungsunterlagen an: schmieder_a@ukw.de
Quellen
Yunna C, Mengru H, Lei W & Weidong C.
Macrophage M1/M2 polarization.
Eur J Pharmacol: 2020; 877:173090.
Schmieder A, Michel J, Schonhaar K, Goerdt S & Schledzewski K.
Differentiation and gene expression profile of tumor-associated macrophages.
Semin Cancer Biol: 2012; 22:289-97.
Aras S, Zaidi MR.
TAMeless traitors: macrophages in cancer progression and metastasis.
Br J Cancer: 2017; 117:1583-91.
Larkin J, Chiarion-Sileni V, Gonzalez R, Grob JJ, Rutkowski P, Lao CD, Cowey CL, Schadendorf D, Wagstaff J, Dummer R, Ferrucci PF, Smylie M, Hogg D, Hill A, Marquez-Rodas I, Haanen J, Guidoboni M, Maio M, Schoffski P, Carlino MS, Lebbe C, McArthur G, Ascierto PA, Daniels GA, Long GV, Bastholt L, Rizzo JI, Balogh A, Moshyk A, Hodi FS & Wolchok JD.
Five-Year Survival with Combined Nivolumab and Ipilimumab in Advanced Melanoma.
N Engl J Med: 2019; 381:1535-46.
Falleni M, Savi F, Tosi D, Agape E, Cerri A, Moneghini L& Bulfamante GP.
M1 and M2 macrophages' clinicopathological significance in cutaneous melanoma.
Melanoma Res: 2017; 27:200-10.
Ausgewählte Publikationen
Kloss, L., Dollt, C., Schledzewski, K., Krewer, A., Melchers, S., Manta, C., Sticht, C., de la Torre, C., Utikal, J., Umansky, V, Schmieder, A. (2019).
ADP secreted by dying melanoma cells mediates chemotaxis and chemokine secretion of macrophages via the purinergic receptor P2Y12.
Cell Death Dis. 2019 Oct 7;10(10):760.
Michel, J., Dollt, C., Kloss, L. Melchers, S., Schledzewski, K., Becker, K., Sauer, A., Krewer, A., Koll, F., and Schmieder, A. (2018).
The novel immunoglobulin super family receptor SLAMF9 identified in TAM of murine and human melanoma influences pro-inflammatory cytokine secretion and migration.
Cell Death & Disease. CDDIS-18-0271R, accepted for publication.
Dollt, C., Becker, K., Michel, J., Melchers, S., Weis, C. A., Schledzewski, K., Krewer, A., Kloss, L., Gebhardt, C., Utikal, J., and Schmieder, A. (2017).
The shedded ectodomain of Lyve-1 expressed on M2-like tumor-associated macrophages inhibits melanoma cell proliferation.
Oncotarget, 103682-103692.
Michel, J., Schonhaar, K., Schledzewski, K., Gkaniatsou, C., Sticht, C., Kellert, B., Lasitschka, F., Geraud, C., Goerdt, S., and Schmieder, A. (2013).
dentification of the novel differentiation marker MS4A8B and its murine homolog MS4A8A in colonic epithelial cells lost during neoplastic transformation in human colon.
Cell death & disease, e469.
Schmieder, A., Schledzewski, K., Michel, J., Schonhaar, K., Morias, Y., Bosschaerts, T., Van den Bossche, J., Dorny, P., Sauer, A., Sticht, C., et al. (2012c).
The CD20 homolog Ms4a8a integrates pro- and anti-inflammatory signals in novel M2-like macrophages and is expressed in parasite infection.
European journal of immunology, 2971-2982.
Schmieder, A., Schledzewski, K., Michel, J., Tuckermann, J. P., Tome, L., Sticht, C., Gkaniatsou, C., Nicolay, J. P., Demory, A., Faulhaber, J., et al. (2011b).
Synergistic activation by p38MAPK and glucocorticoid signaling mediates induction of M2-like tumor-associated macrophages expressing the novel CD20 homolog MS4A8A.
International journal of cancer, 122-132
Kontakt, Öffnungszeiten, Sprechzeiten
Terminvereinbarung Poliklinik
Tel. +49 931 201-26714
Montag bis Donnerstag
12:00 Uhr bis 16:00 Uhr
Freitag
12:00 Uhr bis 15:00 Uhr
Terminvereinbarung Privatambulanz
Montag bis Freitag
08:00 Uhr bis 11:00 Uhr
Margit Körner
Tel. +49 931 201-26354
Claudia Keller
Tel. +49 931 201-26354
E-Mail: privatambulanz-derma@ukw.de
Telefon
Pforte
+49 931 201-26710
Direktor
Prof. Dr. med. Matthias Goebeler
Sekretariat
Gudrun Braun
+49 931 201-26351
Studierendenangelegenheiten
Ute Düchs
+49 931 201-26353
Anschrift
Klinik und Poliklinik für Dermatologie, Venerologie und Allergologie | Josef-Schneider-Straße 2 | Haus D8 | 97080 Würzburg | Deutschland