Würzburg. Das Nebennierenrindenkarzinom, auch bekannt als adrenokortikales Karzinom oder kurz ACC, ist eine sehr seltene und aggressive Form von Krebs, die in der äußeren Schicht der Nebennieren, der sogenannten Cortex oder Rinde, entsteht. „Der einzige kurative Behandlungsansatz ist die komplette chirurgische Resektion“, sagt Prof. Dr. Martin Fassnacht, Leiter der Endokrinologie und Diabetologie am Universitätsklinikum Würzburg (UKW). „Gleichwohl zeigen sich auch nach vollständiger Resektion hohe Raten an Lokalrezidiven und Fernmetastasen mit nur eingeschränkten Behandlungsoptionen. Bislang liegt das mittlere Gesamtüberleben von ACC Patientinnen und -Patienten im fortgeschrittenen Erkrankungsstadium mit etablierter Standardtherapie bei weniger als 15 Monaten.“
Schoeller-Junkmann Preis der DGE
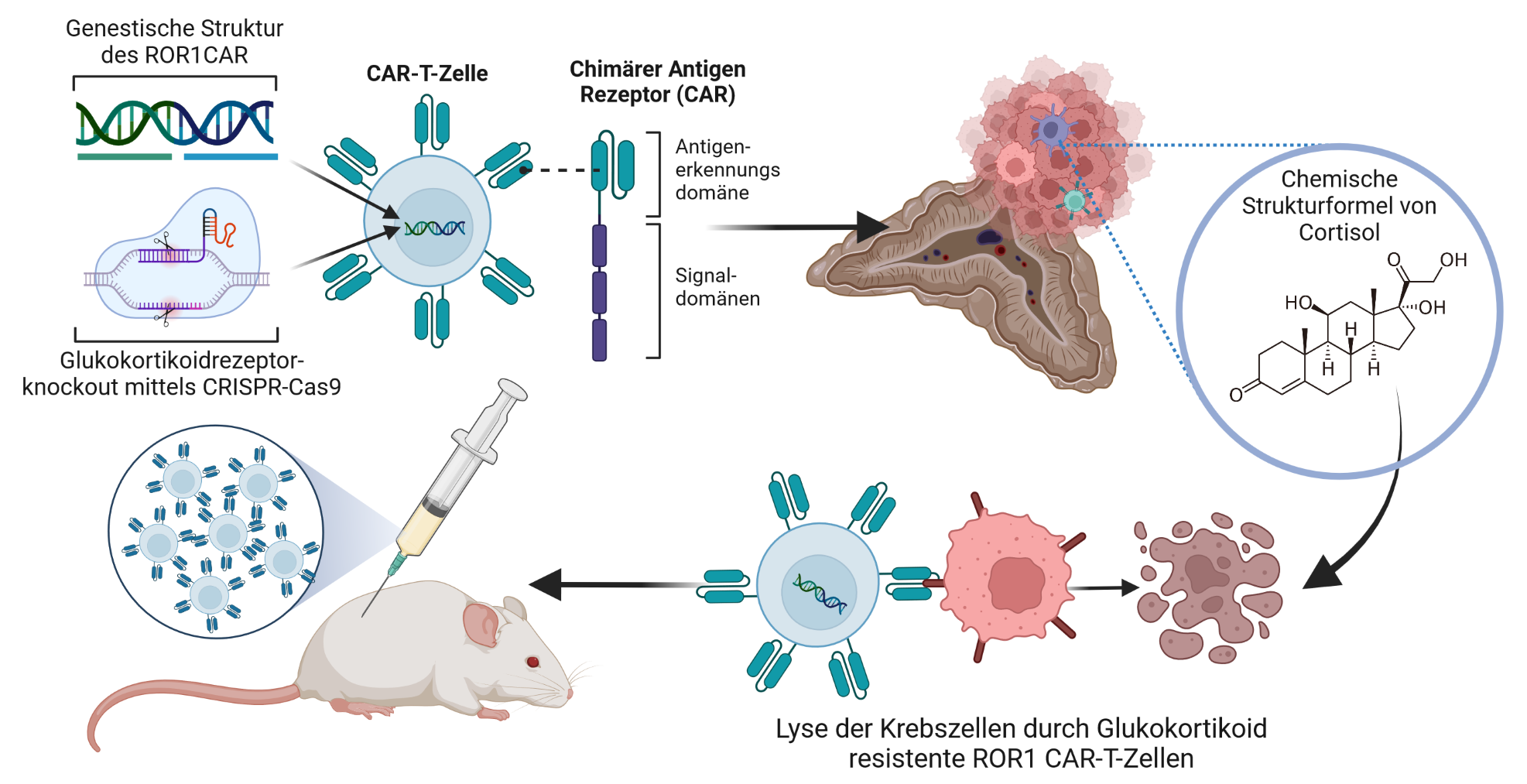
Hoffnung bringen neue Erkenntnisse aus seiner Arbeitsgruppe, für die Marc Philipp Schauer und Dr. Laura-Sophie Landwehr auf dem diesjährigen Kongress der Deutschen Gesellschaft für Endokrinologie (DGE) in Rostock mit dem Schoeller-Junkmann-Preis ausgezeichnet wurden. Mit 12.000 Euro ist er der höchstdotierte Preis der DGE. Die Biomedizinerin und der Doktorand zeigen in ihrem Forschungsprojekt, wie das onkogene Protein ROR1, das auf ACC Tumoren im Vergleich zu gesunden Nebennieren stark überexprimiert ist, mittels genetisch modifizierter Immunzellen gezielt angegriffen werden kann.
Bei der neuartigen Therapieform werden patienteneigene T-Zellen des Immunsystems mit einem synthetischen Rezeptor, einem so genannten Chimären Antigen-Rezeptor (CAR) ausgestattet, um die körpereigenen Immunzellen gegen den Tumor zu sensibilisieren und diesen anzugreifen. Je nach Art der Tumorerkrankung muss ein Zielmolekül identifiziert und validiert werden, um den Sensor entsprechend maßzuschneidern. Bei endokrinen Tumoren hat sich das Zielmolekül namens ROR1 als möglicher Angriffspunkt erwiesen.
ROR1 CAR-T-Zellen resistent gegen Glukokortikoide
Marc Philipp Schauer und Laura-Sophie Landwehr beleuchten in ihrer Arbeit die Entwicklung sowie den präklinischen Nutzen von verschiedenen ROR1 CAR-T-Zellmodifikationen und den Einfluss durch die vom Tumor produzierten und das Immunsystem unterdrückenden Glukokortikoide. In 60 Prozent der Nebennierenrindenkarzinom-Fälle werden hohe Mengen an Glukokortikoiden produziert. Diese Hormone sind unter anderem an der Regulation des Immunsystems beteiligt. Eine Überproduktion führt zu einem Zustand, der als Cushing-Syndrom bekannt ist und unter anderem durch Gewichtszunahme, Fettansammlung im Gesicht und am Rumpf, Stiernacken, Muskelschwäche, Bluthochdruck, erhöhten Blutzuckerspiegel und Stimmungsschwankungen gekennzeichnet ist.
„Einen Quantensprung in unserer Forschung stellte die Verwendung fortschrittlichster Genom-Editierungstechniken dar, mit deren Hilfe es uns gelang, Glukokortikoid-resistente CAR-T Zellen herzustellen“, berichtet Dr. Justus Weber, der in der Arbeitsgruppe von Prof. Dr. Michael Hudecek am Lehrstuhl für zelluläre Immuntherapie die ROR1 CAR-T-Zellen entwickelt hat.
„Wir zeigen, dass Glukokortikoid-resistente CAR-T-Zellen Glukokortikoid-angereicherte Tumorumgebungen gezielt umgehen können und ACC Tumore sehr effizient in vitro und in vivo heilen können“, ergänzt Laura-Sophie Landwehr. Das heißt, die modifizierten ROR1 CAR-T-Zellen bekämpfen die Mechanismen eines immunsupprimierten Tumormikromilieus.
„Die hier entwickelte Therapie könnte einen neuartigen und potentiell kurativen Behandlungsansatz für Patienten und Patientinnen mit fortgeschrittenem ACC darstellen und somit ihr Gesamtüberleben effizient verlängern könnte“, kommentiert Marc Philipp Schauer. Denn bisherige Immuntherapieversuche im ACC mit Immuncheckpoint-Inhibitoren haben bislang lediglich moderate Erfolge verzeichnen können.
ROR1-Molekül im Visier bei verschiedenen Tumoren
Die gezeigten Forschungsergebnisse bieten aber nicht nur einen Therapieansatz für das Nebennierenrindenkarzinom, sondern auch für andere Tumorarten. So hat sich das Zielmolekül ROR1 ebenfalls als Angriffspunkt bei hämatologischen Krebserkrankungen und soliden Tumoren wie Lungen-, Brust- und Eierstockkrebs hervorgetan. Prof. Dr. Michael Hudecek, Leiter des Lehrstuhls Zelluläre Immuntherapie am UKW, konnte mit seinem Team als erster ein ROR1-spezifisches CAR-Konstrukt erstellen und dessen zytotoxischen Effekte gegen ROR1+ hämatologische Krebserkrankungen in vitro und in vivo zeigen. Den effektiven Einsatz von ROR1 CAR-T-Zellen gegen solide Tumore hat das Team aus Würzburg in einem fortschrittlichen mikrophysiologischen 3D-Tumormodell veranschaulicht.
ROR1 geht in klinische Prüfung
Als nächstes werden die entwickelten ROR1 CAR-T-Zellen in der first-in-human Phase I Studie (LION-1) am Menschen getestet, wo diese im Idealfall einen klinischen Nutzen entfalten können. Hierbei kommt zunächst ein Zellprodukt ohne Genom-Editierung zum Einsatz. In nächster Instanz sollen dann die Sicherheit und Effektivität eines Glukokortikoid-resistenten ROR1 CAR-T-Zellprodukts im Rahmen einer LION-1 2.0-Studie untersucht werden. Zudem wird am UKW auf präklinischer Ebene daran gearbeitet, weitere Ansätze im T-Zelltherapiebereich zu entwickeln und neue Modifikationen zu testen, die ebenfalls Einlass in die Klinik erhalten könnten.
Förderung und Kooperationspartner
Das Forschungsprojekt zur Immuntherapie beim Nebennierenrindenkarzinom wurde gefördert von der Deutschen Forschungsgesellschaft (DFG) im Rahmen des Sonderforschungsbereichs/Transregio Nebenniere (SFB TRR 205) und des Sonderforschungsbereichs/Transregio LETSIMMUN (SFB TRR 338). Beteiligt waren neben der Arbeitsgruppe von Prof. Dr. Martin Fassnacht mit Dr. Laura-Sophie Landwehr und Marc P. Schauer die Arbeitsgruppe von Prof. Dr. Michael Hudecek mit Dr. Justus Weber sowie Prof. Dr. Dr. Matthias Kroiss vom LMU Klinikum München (ehemals UKW) und Prof. Katja Kiseljak-Vassiliades von der University of Colorado.