Würzburg. Ohne ihn hätten wir Schwierigkeiten, uns auf den Beinen zu halten, uns fortzubewegen und uns im Raum zu orientieren. Unser Gleichgewichtssinn ist für unser tägliches Funktionieren von entscheidender Bedeutung. Er besteht aus mehreren Komponenten, unter anderem dem Innenohr mit den so genannten Vestibularorganen, deren Signale über weite Teile des Gehirns und Rückenmarks verschaltet werden. Sobald wir uns bewegen oder unsere Kopfhaltung verändern, senden die Vestibularorgane Signale ans Gehirn, das die Informationen verarbeitet und entsprechende Anpassungen der Augenstellung und Körperhaltung veranlasst, damit wir im Gleichgewicht bleiben. Störungen des Gleichgewichtssinns mindern unsere Lebensqualität drastisch und können sogar zur Arbeitsunfähigkeit oder langfristig zu Depressionen und Angstzuständen führen. Diese Tatsachen sind bekannt, aber die Therapiemöglichkeiten sind sehr begrenzt.
Atlas vom neuronalen Netzwerk des Gleichgewichtssinns
Dr. Maximilian U. Friedrich will das ändern. „Erkrankungen des Gleichgewichtssinns wie Schwindel, Störungen des Ganges und der räumlichen Orientierung zählen zu den häufigsten Symptomen überhaupt in der Medizin“, sagt der 35-jährige Assistenzarzt und Wissenschaftler vom Universitätsklinikum Würzburg (UKW). „Die Neurologie hat sich mit der Entwicklung innovativer Hirnstimulationsmethoden mittlerweile zu einem therapeutischen Fach gewandelt - jedoch profitieren davon aktuell noch keine Patientinnen und Patienten mit Gleichgewichtsstörungen.“
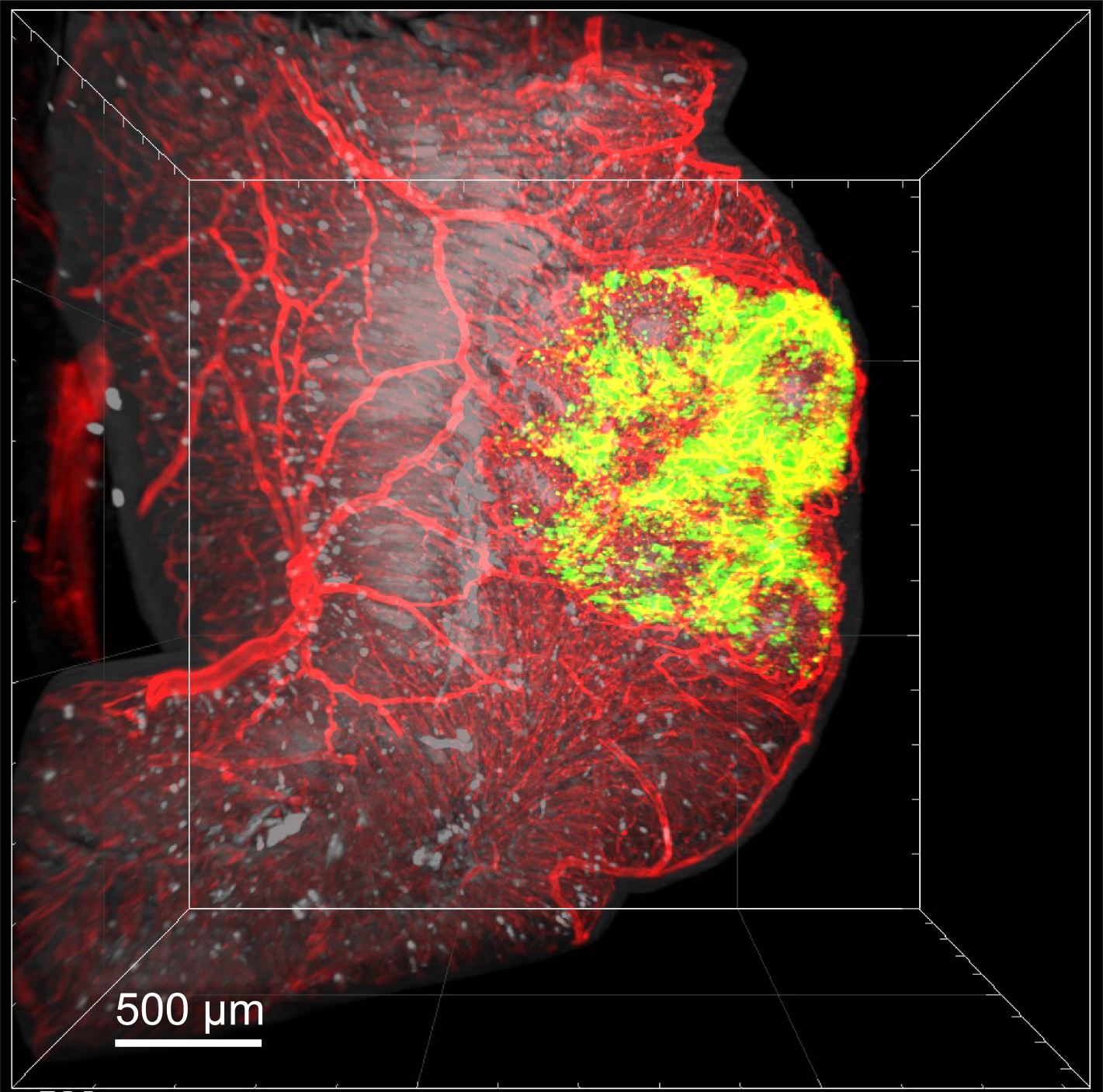
Mit modernsten Methoden der Hirnbildgebung und Künstlicher Intelligenz will Maximilian U. Friedrich neue Therapieansätze bei komplexen Gleichgewichtserkrankungen erforschen, die besonders häufig bei neurologischen Erkrankungen wie dem Schlaganfall, der Multiplen Sklerose oder der Parkinsonerkrankung auftreten. „Hierfür werde ich unter anderem schlaganfallbedingte Schädigungen von Gleichgewichtsnetzwerken als Modell nutzen, um Struktur-Funktionsbeziehungen des Gleichgewichtssystems aufzuschlüsseln und zu kartografieren.“
Jung-Karriere-Förderpreis für translationale Forschung in der Neurologie
Sein Forschungsvorhaben und bisherigen Erkenntnisse überzeugten die Hamburger Jung-Stiftung für Wissenschaft und Forschung so sehr, dass sie Maximilian U. Friedrich am 2. Mai in Hamburg den mit 210.000 Euro dotierten Jung-Karriere-Förderpreis verleiht. Mit dem Preisgeld will der gebürtige Franke, der derzeit als Clinician Scientist in der Neurologie und Postdoktorand am Center for Brain Circuit Therapeutics des Brigham & Women's Hospital und Forschungsstipendiat an der Harvard Medical School in Boston arbeitet, ab Oktober 2024 eine eigene Arbeitsgruppe am UKW aufbauen.
Bisher untersuchte Maximilian Friedrich unter anderem, wie schlaganfallbedingte Verletzungen und Hirnstimulation die visuelle und Gleichgewichtswahrnehmung sowohl im Menschen als auch im Mausmodell beeinflussen, wofür er mit dem James A. Sharpe Award der nordamerikanischen neuroophthalmologischen Gesellschaft ausgezeichnet wurde. Ihm gelang es, auf künstlicher Intelligenz basierende Systeme zu entwickeln, mit dem sich neurologische Bewegungsstörungen oder Augenzittern, wie es für Gleichgewichtserkrankungen charakteristisch sind, nur mit handelsüblichen Smartphones analysieren lassen. Die Ergebnisse sind mit denen bisheriger teurer Spezialmethoden vergleichbar, so dass seine Erkenntnisse künftig bei medizinischen Untersuchungen direkt am Krankenbett eine Rolle spielen könnten. Zusammen mit einer Arbeitsgruppe aus Australien gelang es ihm vor kurzem rund 750.000 Australische Dollar für ein Verbundvorhaben zur Weiterentwicklung künstlicher Intelligenzmethoden in der Neurologie einzuwerben.
Vom Tontechniker und Zivi zum Neurologen, Wissenschaftler und DJ
Ursprünglich studierte Maximilian U. Friedrich Germanistik, Philosophie und Klassische Philologie. Doch der Zivildienst als Krankenpfleger brachte ihn zur Medizin und schlussendlich zu einem anderen Blick auf den Geist. Nach der Aufnahme seines Medizinstudiums in Würzburg stellte sich schnell heraus, dass ihn besonders die Neurophysiologie begeisterte. „Das lag eigentlich nahe“, schmunzelt er. „In meiner Jugend habe ich mich als Tontechniker engagiert und viel mit Schaltkreisen und Signalprozessierung hantiert.“ Heute erzeugt er übrigens als DJ Musik aus elektrischen Schaltkreisen, sofern er nicht gerade an Hirnschaltkreisen forscht.
Den Funken für sein späteres Spezialgebiet - Störungen von Gleichgewicht, Augenbewegungen und Motorik – zündeten seine Mentoren während des Praktischen Jahres und der frühen Assistenzarztzeit: Dr. Mathias Pfau, Oberarzt im KWM Juliusspital und Prof. Dr. Jens Volkmann, Direktor der Neurologie am UKW. „Sie schafften es, die komplexesten neurologischen Rätsel direkt am Patientenbett zu lösen, allein durch die nuancierte neurologische Untersuchung der Augen- und Körpermotorik, und fast ohne den Einsatz von Apparaten. Diese Kunstfertigkeit hat mich inspiriert“, schildert Maximilian U. Friedrich. Er absolvierte in der Neurologie des UKW eine vom Interdisziplinären Zentrum für Klinische Forschung (IZKF) geförderte Ausbildung zum Clinician Scientist und baute zusammen mit Dr. Miriam Bürklein, Oberärztin der HNO-Klinik am UKW, ein interdisziplinäres Schwindelboard und eine Spezialambulanz für komplexe Gleichgewichtserkrankungen auf. In Kooperation mit Prof. Daniel Zeller, Oberarzt der Neurologischen Klinik am UKW und Prof. Martin Nentwich, stellv. Direktor der Augenklinik am UKW, gelang es ihm weiterhin, ein klinisch-wissenschaftliches Labor mit weltweit führender Ausstattung für Augenbewegungsanalysen am UKW zu etablieren.
Der Weg zum Clinician Scientist sei sicher nicht immer einfach, umso mehr freue er sich über die Auszeichnung. „Die Förderung ermöglicht es mir nun, an meine bisherigen Forschungen anzuknüpfen und mein ganzheitliches klinisch-wissenschaftliches Programm zu verwirklichen.“ Zum Schluss schimmert noch einmal der Philosoph durch, als Maximilian U. Friedrich sein an Seneca angelehntes Motto zitiert: Per aspera ad astra - Über steinige Wege gelangt man zu den Sternen.
Über die Jung-Stiftung für Wissenschaft und Forschung
Die Jung-Stiftung für Wissenschaft und Forschung mit Sitz in Hamburg ehrt mit drei jährlich vergebenen Preisen Projekte der Grundlagen- und weiterführenden Forschung von besonderer klinischer Relevanz. Mehr als 15 Mio. Euro hat die Stiftung damit bis heute in die Förderung von Forscherinnen und Forschern investiert, die mit ihren Projekten eine Brücke von der Forschung zum Krankenbett schlagen. Unter dem Motto „Ausgezeichnete Humanmedizin“ trägt die Stiftung so maßgeblich zur Entwicklung neuer Therapiemöglichkeiten bei. Der Jung-Preis für Medizin, die Jung-Medaille für Medizin in Gold und der Jung-Karriere-Förderpreis für medizinische Forschung zählen in ihrer Gesamtsumme europaweit zu den höchstdotierten Medizinpreisen. Mit der zusätzlichen Vergabe von Fellowships und Deutschlandstipendien kommt die Stiftung so auf Förderungen im Wert von insgesamt bis zu 650.000 Euro jährlich. Mehr Informationen unter www.jung-stiftung.de
Text: Kirstin Linkamp / UKW