Würzburg. Mitte des 19. Jahrhunderts fielen sie erstmals als kleine Kügelchen im Blut auf, um die Jahrhundertwende wurde ihre Funktion bei der Blutgerinnung, der sogenannten Hämostase, und der Entstehung von Thrombosen entdeckt, und einige Jahre später kannte man auch den Ort ihrer Bildung im Knochenmark, wo die Blutplättchen von ihren Vorläuferzellen, den Megakaryozyten abgeschnürt werden. Die Biologie dieser kleinen kernlosen Zellen, die nur einen Tausendstel Millimeter groß sind, und von denen wir etwa 250 Millionen in jedem Milliliter Blut haben, hat sich nach und nach zu einem großen Forschungsgebiet entwickelt. Inzwischen ist klar, dass Blutplättchen, in der Fachsprache Thrombozyten genannt, viel mehr können als Blutungen stillen und Infarkte auslösen. Als Modulatoren des Immunsystems treiben sie auch Entzündungsprozesse voran und begünstigen so Gewebeschädigungen.
Thrombo-Inflammation: Von Blutplättchen ausgelöste Entzündungsprozesse
Prof. Dr. Bernhard Nieswandt, Leiter des Lehrstuhls für Experimentelle Biomedizin I am Uniklinikum Würzburg (UKW) und Forschungsgruppenleiter am Rudolf-Virchow-Zentrum (RVZ) der Universität Würzburg (JMU), war an diesen Erkenntnissen maßgeblich beteiligt und hat den Begriff „Thrombo-Inflammation“ geprägt. Für seine Pionierarbeit in der Blutplättchenforschung, seine neueste Entdeckung und weiterführende Untersuchungen wurde er jetzt mit einem ERC Advanced Grant in Höhe von 2,5 Millionen Euro ausgezeichnet. Die Advanced Grants des European Research Councils (ERC) sind Teil des EU-Programms Horizon Europe und richten sich an etablierte Spitzenforscherinnen und -forscher. Der Grant gehört zu den prestigeträchtigsten und kompetitivsten wissenschaftlichen Auszeichnungen und Instrumenten der EU-Forschungsförderung (siehe Info-Kasten weiter unten).
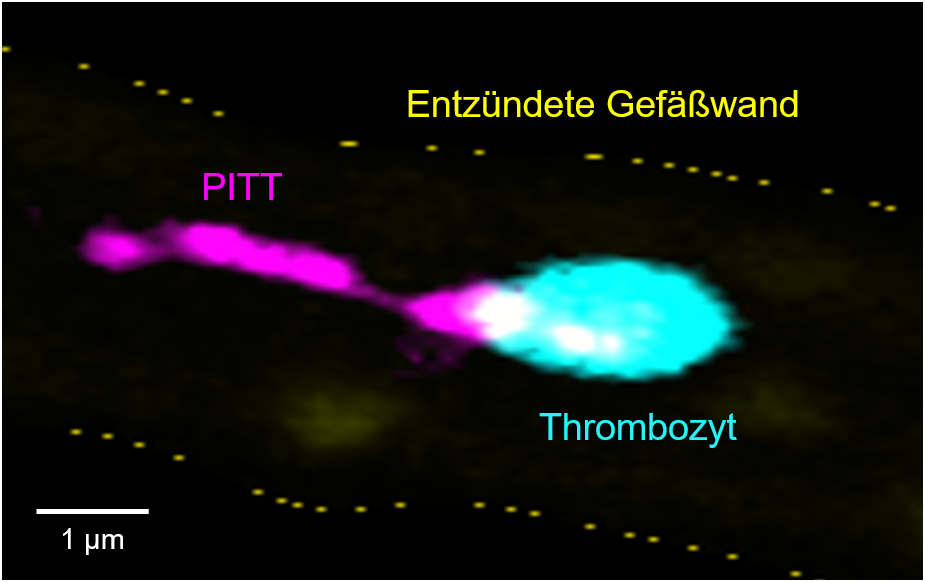
PITT-Inflame: abgespaltene Organellen, die Immunfunktionen steuern
Der Preis ist für Bernhard Nieswandt Anerkennung und Ansporn zugleich, weiter seinem wissenschaftlichen Instinkt zu folgen, am Puls der Zeit zu forschen und Durchbrüche in dem Verständnis von Erkrankungen wie Schlaganfall, Blutvergiftung (Sepsis) oder akutem Lungenversagen (ARDS) zu erzielen. Bei der Entstehung dieser Erkrankungen spielen Thrombozyten nämlich eine maßgebliche Rolle. Und um die geht es auch im neuen ERC-Projekt „PITT-Inflame“, ein Akronym für “Platelet-derived Integrin- and Tetraspanin-enriched Tethers as key effectors in thrombo-Inflammation”. PITT sind dabei kometenschweifartige, von Thrombozyten abgespaltene Organellen, die mit anderen Zellen im Gefäßsystem interagieren und so Entzündungen vorantreiben.
„Konkret wollen wir einen zellulären Mechanismus von Thrombozyten analysieren, der noch nie beschrieben wurde und den wir in meiner Arbeitsgruppe eher beiläufig entdeckt haben“, berichtet Bernhard Nieswandt. „Eigentlich ist das Leben eines Thrombozyten nach seiner Aktivierung und Anhaftung an Verletzungsstellen schnell vorbei, und er wird von Phagozyten entsorgt. Doch wir konnten sehen, dass nicht aktivierte Thrombozyten im Blutstrom einen unerwarteten Prozess zellulärer Reorganisation durchlaufen, der dazu führt, dass sie Teile ihrer Membran dort deponieren, wo Entzündungsprozesse ablaufen und diese damit befeuern.“ Im ersten Teil des ERC-Projekts möchte Bernhard Nieswandt erforschen, wie es zu dieser Reorganisation kommt und der Thrombozyt einen kleinen Teil von sich selbst hinterlässt, eine Organelle, angefüllt mit Kommunikationsmolekülen, die Immunfunktionen steuern, aber auch entzündliche Gewebeschädigung begünstigen kann.
100.000 Moleküle werden reorganisiert
Erstaunt habe ihn, dass sich Integrine, also bestimmte Adhäsionsrezeptoren, die am Zytoskelett der Zelle hängen, absolut frei in der Membran bewegen können und 100.000 Moleküle blitzschnell in eine bestimmte Region der Zelloberfläche (Mikrodomäne) gebracht werden. „Da muss in der Zelle eine Art Sortiermaschine vorhanden sein, die den gesamten Bestand ihrer wichtigsten Adhäsionsrezeptoren zusammen mit assoziierten Membranproteinen, den Tetraspaninen, als Bausteine für neuartige Zellorganelle, die PITTs, reorganisiert.“ Nieswandt hat erste Hinweise, dass diese Organellen mit Signalmolekülen, Ribosomen und RNA beladen sind und somit die Funktion ihrer Zielzellen verändern können. Nachdem der Biologe mit seinem Team eine detaillierte molekulare Zusammensetzung und Architektur von PITTs geliefert und die zugrundeliegenden Signalnetzwerke entschlüsselt hat, plant er im zweiten Teil des Projekts, PITT-induzierte Effekte auf den Zielzellen zu identifizieren und aus den gewonnenen Erkenntnissen therapeutische Strategien abzuleiten.
„Spätestens bei Covid-19 haben wir gelernt, was Thrombo-Inflammation tatsächlich bedeutet“
Zahlreiche seiner Erkenntnisse und Patente sind bereits erfolgreich im klinischen Einsatz, oder auf dem Weg dorthin. Beispiel ischämischer Schlaganfall: Wurde der Thrombus, der die Blutversorgung in einem bestimmten Teil des Gehirns unterbrochen hat, erfolgreich entfernt, und der Blutfluss wiederhergestellt, kann es immer noch zu einer Entzündungsreaktion und daraus resultierenden Hirnschädigungen kommen. Die Mechanismen, die dieser von Thrombozyten gesteuerten Entzündung zugrunde liegen, haben Bernhard Nieswandt und sein Team einst gemeinsam mit der Neurologie am UKW aufgedeckt. Erste Studien mit Inhibitoren, die diese Entzündungsreaktion unterdrücken, verliefen erfolgsversprechend. Und auch beim akuten Lungenversagen, was vor allem in der Corona-Pandemie viele Menschen getroffen hat, ist eine überschießende Immunreaktion angetrieben durch außer Kontrolle geratene Blutplättchen, beteiligt. „Spätestens bei Covid-19 haben wir gelernt, was Thrombo-Inflammation tatsächlich bedeutet“, erklärt Bernhard Nieswandt. Mit dem Glykoprotein VI (GPVI), das sich auf der Oberfläche von Thrombozyten befindet, hat seine Arbeitsgruppe einen vielversprechenden Angriffspunkt für die Behandlung solcher entzündlichen Krankheitsprozesse gefunden. „Indem wir GPVI gezielt mit einem Antikörper hemmen, können wir den verheerenden Einstrom von Entzündungszellen ins Lungengewebe unterbinden und die daraus resultierende Gewebeschädigung der entzündeten Lunge deutlich reduzieren, ohne das Risiko von Entzündungsblutungen zu erhöhen“, erläutert Nieswandt. Er hat nicht nur einen Mechanismus entdeckt, wie man GPVI hemmen kann, sondern auch gezeigt, wie dieser Rezeptor aus Thrombozyten entfernt werden kann, was zukünftig von erheblichem therapeutischem Nutzen sein könnte.
Neue Wege für die Behandlung eines breiten Spektrums von Krankheiten
Zurück zu PITT-Inflame: „Unsere Hypothese ist, dass zirkulierende Thrombozyten die Fähigkeit haben, ihre wichtigsten Adhäsions- und Signalisierungsmechanismen auf zwei grundlegend verschiedene Arten zu nutzen und dadurch zwischen hämostatischen und einem thrombo-inflammatorischen Funktionen zu wechseln. Sollte sich diese Annahme bestätigen, würde dies eine grundlegend neue Forschungsrichtung in der Thrombozytenbiologie begründen und vielversprechende Wege für die Behandlung eines breiten Spektrums von Krankheiten mit großen Auswirkungen auf die Gesellschaft eröffnen“, fasst Bernhard Nieswandt zusammen.
Über Bernhard Nieswandt
Bernhard Nieswandt (Jahrgang 1968) studierte in Regensburg und Canterbury (UK) Biologie und Biochemie. Bereits als Doktorand in Regensburg beschäftigte er sich mit dem damals noch gänzlich neuen Forschungsgebiet Thrombozyten und Entzündung und entwickelte die weltweit ersten Antikörper gegen Maus-Thrombozyten, die wichtige Werkzeuge bei der Erforschung dieser Zellen wurden. Nach seiner Promotion im Jahr 1997 wechselte er an die Universität Witten/Herdecke, wo er sich habilitierte. Im Februar 2002 zog er nach Würzburg und treibt seither vor allem die kardio- und neurovaskuläre Forschung mit bahnbrechenden Entdeckungen voran. Er baute im neu gegründeten Rudolf-Virchow-Zentrum als erster eine Arbeitsgruppe auf, wurde zwei Jahre später Professor und übernahm im Jahr 2008 die Leitung des Lehrstuhls I für Experimentelle Biomedizin. Mit seinem Team hat er die Grundlagen für zwei Medikamente gelegt: Ein Faktor XIIa-Inhibitor von CSL Behring, der gerade von der US-amerikanischen Food and Drug Administration FDA zugelassen wurde und von der Europäischen Arzneimittelagentur EMA geprüft wird, und ein GPVI-Inhibitoren, die gerade in der klinischen Phase III angekommen sind.
Bernhard Nieswandt hat in Würzburg bislang 26 Postdocs, 41 Doktorarbeiten und 24 Master-Studierende betreut. Seit 1999 hat er über 320 Publikationen veröffentlicht, die mehr als 26,000-mal zitiert wurden. Acht Patente wurden erteilt, drei weitere sind noch in Begutachtung. Bernhard Nieswandt lebt mit seiner Familie in Eibelstadt, wo er mit seiner Firma EMFRET Analytics Antikörper für die kardiovaskuläre Forschung herstellt.
Über die ERC Advanced Grants
Die ERC Advanced Grants sind Teil des EU-Programms Horizon Europe und richten sich an etablierte Spitzenforscherinnen und –forscher. Die Preise gehören zu den prestigeträchtigsten und kompetitivsten der EU. Der ERC gab am Donnerstag, 11. April, die Namen von insgesamt 255 herausragenden Wissenschaftlerinnen und Wissenschaftlern in Europa bekannt, die mit dem ERC Advanced Grant ausgezeichnet werden. Mit den neuen Zuschüssen im Gesamtwert von 652 Millionen Euro werden Forschungsprojekte in einem breiten Spektrum unterstützt, das von Biowissenschaften über die Naturwissenschaften bis hin zu den Sozial- und Geisteswissenschaften reicht. Spitzenreiter unter den erfolgreichen Bewerberinnen und Bewerbern ist Deutschland mit insgesamt 50 Preisen, gefolgt von Frankreich mit 37 und Großbritannien mit 28. Insgesamt wurden 1829 Anträge eingereicht. Mit der Förderung werden nicht nur die Forschenden dabei unterstützt, wissenschaftliches Neuland zu betreten, sondern auch rund 2.500 Arbeitsplätze in ganz Europa geschaffen, so Illiana Ivanova, Kommissarin für Innovation, Forschung, Kultur, Bildung und Jugend. Hier geht es zur Pressemitteilung des ERC.
Ebenfalls mit einem ERC Advanced Grant ausgezeichnet wurde der Würzburger Physikochemiker Tobias Brixner, der am Lehrstuhl für Physikalische Chemie I an der Julius-Maximilians-Universität (JMU) Würzburg zu elektronischen Anregungen forscht. Dafür erhielt er eine Fördersumme von 2,5 Millionen Euro. Hier geht es zur Pressemitteilung der JMU.