

Würzburg. Weltweit leiden Millionen von Kindern Mangelernährung und den damit verbundenen gesundheitlichen Folgen. Dazu gehört auch die sogenannte umweltbedingte Enteropathie („environmental enteropathy“, altgriechisch énteron für Darm und páthos für Leiden). Bisher wurde angenommen, dass diese chronische Darmentzündung durch unhygienische Lebensbedingungen, häufige Aufnahme von Krankheitserregern und ein ungünstiges Darmmikrobiom verursacht wird. Die bei Mangelernährung auftretende Enteropathie führt zu einer verminderten Aufnahmefähigkeit des Darms für Nährstoffe und damit zusätzlichen Verstärkung der Mangelernährung - ein Teufelskreis.
Prof. Dr. Dorothee Viemann, Leiterin der Translationalen Pädiatrie am Universitätsklinikum Würzburg (UKW), untersuchte mit ihrem Team und einer Schweizer Forschergruppe vom Institut für Biomedizinische Forschung der Universität della Svizzera Italiana, welchen Einfluss eine mütterliche Mangelernährung auf die Gesundheit des Kindes, insbesondere auf die Darmentwicklung, hat. Die Ergebnisse wurden jetzt in der renommierten Fachzeitschrift Nature Communications veröffentlicht.
Körpereigene Proteine S100A8/A9 kommen in hohen Mengen in Muttermilch vor
„Wir konnten im Mausmodell zeigen, dass eine Mangelernährung der Mutter ausreicht, um beim Neugeborenen schon während der Stillzeit eine Darmentzündung auszulösen. Eine wichtige Rolle spielen dabei die körpereigenen Proteine S100A8/A9. Diese kommen in der Muttermilch in großen Mengen vor, sind aber bei Mangelernährung der Mutter deutlich reduziert“, berichtet Erstautorin Julia Heckmann. Die Doktorandin hatte bereits ihre Masterarbeit in Biomedizin an der Medizinischen Hochschule Hannover (MHH) bei der Neonatologin und Immunologin Dorothee Viemann geschrieben und war vor drei Jahren mit ihrer Professorin nach Würzburg gewechselt, um sich auch in ihrer Doktorarbeit mit den Proteinen der S100-Familie und ihrer ambivalenten Funktion zu beschäftigen. Denn die so genannten Alarmin-Proteine, die bei Stress oder Zellschäden als Gefahrensignal freigesetzt werden, tragen dazu bei, entzündungsfördernde Prozesse sowohl zu regulieren als auch zu verstärken.
Alarmine beeinflussen die Entwicklung der Darmflora und des Immunsystems nach der Geburt
Dorothee Viemann beschrieb bereits während ihrer Tätigkeit in Hannover die Rolle von S100-Alarminen in der Regulation der körpereigenen Abwehr von Neugeborenen. S100-Alarmine sorgen dafür, dass das Immunsystem von Säuglingen in den Monaten nach der Geburt zunächst ganz bewusst mit angezogener Handbremse läuft. Zum einen, damit sich die körpereigenen Abwehrtruppen nicht in unzählige Scharmützel mit neuen Bakterien und Fremdkörpern verwickeln lassen und dabei starke, lebensgefährliche Entzündungsreaktionen auslösen. Zum anderen, damit sich der Darm mit bestimmten Bakterien besiedeln und das sogenannte Mikrobiom bilden kann.
„Kindern, die nach der Geburt zu wenig dieser Alarmin-Proteine bilden, fehlt diese Handbremse, weshalb sie ein massiv erhöhtes Risiko für schwere Infektionsverläufe haben. Vor allem bei Frühgeborenen, denen es an S100A8/A9 mangelt, ist das Sepsisrisiko deutlich erhöht“, sagt Dorothee Viemann, die gemeinsam mit dem Direktor der Universitäts-Kinderklinik, Prof. Dr. Christoph Härtel, im Forschungsprojekt PROSPER (Prevention of Sepsis by personalized nutritional S100A8/A9 supplementation to vulnerable neonates) untersucht, ob eine Nahrungsergänzung mit S100A8/A9 Frühgeborene mit niedrigen Alarmin-Spiegeln vor einer Sepsis schützt.
Mehr als 10 Prozent der kindlichen Todesfälle sind auf Darminfektionen zurückzuführen
Doch auch bei Reifgeborenen kann ein Mangel an S100A8/A9 zu chronischen Darmentzündungen und zu einer ungünstigen Keimbesiedlung des Darms führen, wenn eben nicht genügend dieser Alarmine in der Muttermilch vorhanden sind. Dazu kann es kommen, wenn die Mütter z.B. unterernährt oder fehlernährt sind. Die häufigste Form der Unterernährung ist die Protein-Energie-Mangelernährung. Sie führt bei Kindern zu Wachstumsstörungen und macht sie besonders anfällig für Infektionen, insbesondere für Darminfektionen, die für mehr als 10 Prozent der Todesfälle bei Kindern verantwortlich sind.
In ihrer Studie, die von der Bill & Melinda Gates Foundation und dem Bundesministerium für Bildung und Forschung (BMBF) gefördert wurde, legen die Wissenschaftlerinnen den Fokus auf einen Zeitraum, der in der Erforschung umweltbedingter Enteropathien bislang kaum Beachtung fand: die Stillzeit. Das verminderte S100A8/A9 in der Muttermilch mangelernährter Mütter legt den Grundstein für eine lebenslang erhöhte Suszeptibilität, also Empfänglichkeit, für überschießende Darmentzündungen.
Einmalige Gabe des Proteins S100A8 direkt nach der Geburt schützt vor Darmentzündung
„Unsere aufregendste Entdeckung war, dass eine einmalige Gabe von S100A8 an Neugeborene eine gesunde Darmentwicklung sicherstellt - und zwar lebenslang“, freut sich Julia Heckmann. Eine Nahrungsergänzung mit S100A8 könnte daher eine vielversprechende und einfache Behandlungsmöglichkeit darstellen, um die kindliche Darmentwicklung bei reduzierten S100A8/A9-Spiegeln in der Muttermilch, aber auch generell bei reduzierter oder fehlender Muttermilchzufuhr zu schützen. „Milchersatzprodukte enthalten kein S100A8/A9, sollten aber aufgrund unserer Ergebnisse dringend in Betracht gezogen werden“, rät Dorothee Viemann.
Präklinische Studie untersucht Wirksamkeit, Sicherheit und Dosierung der Nahrungsergänzung mit S100A8/A9
Ob sich diese Erkenntnisse vom Mausmodell auf den Menschen übertragen lassen, wie wirksam und sicher die Nahrungsergänzung ist und welche Dosierung geeignet ist, untersucht das Team bereits in einer neuen Studie, die vom BMBF gefördert wird. „In der präklinischen Studie wollen wir die Wirkung der Nahrungsergänzung mit S100A8/A9 auf Erkrankungen und das Darmmikrobiom testen, mögliche Nebenwirkungen aufdecken und Dosisempfehlungen für eine klinische Studie geben“, sagt Dorothee Viemann.
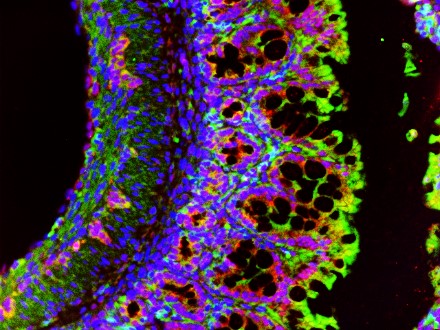
Nachdem der Effekt von S100A8/A9 auf das Immunsystem des Neugeborenen relativ gut verstanden ist, will das Team außerdem untersuchen, wie die Alarmine auf die Epithelzellen der Darmschleimhaut wirken. Die Epithelzellen bilden schließlich die erste Zellschicht im Darm, mit der S100A8/A9 aus der Muttermilch in Kontakt kommt.
Publikation:
Perruzza, L., Heckmann, J., Rezzonico Jost, T. et al. Postnatal supplementation with alarmins S100a8/a9 ameliorates malnutrition-induced neonate enteropathy in mice. Nat Commun 15, 8623 (2024). https://doi.org/10.1038/s41467-024-52829-x
Text: Kirstin Linkamp / UKW