
Würzburg. Veränderungen im Darm können sich nicht nur auf die Verdauung, sondern auch auf die psychische Gesundheit und das Nervensystem auswirken. So weiß man heute, dass viele neurologische Erkrankungen wie Parkinson, Multiple Sklerose oder Depressionen mit Problemen im Darm zusammenhängen. Mehrere Publikationen haben bereits gezeigt, dass Immunzellen aus dem Darm ins Gehirn wandern können. Eine neue Erkenntnis in der ebenso komplexen wie faszinierenden Welt der Darm-Hirn-Achse hat Juniorprofessorin Dr. Rhonda McFleder vom Uniklinikum Würzburg (UKW) jetzt in der renommierten Fachzeitschrift Nature Communications veröffentlicht. „In unserer aktuellen Studie zeigen wir, dass die Kommunikation zwischen Gehirn und Darm keine Einbahnstraße ist. Zellen können auch vom Gehirn in den Darm wandern und so die Ausbreitung von Krankheiten vermitteln“, erklärt die Neurobiologin, die gemeinsam mit Prof. Dr. Chi Wang Ip an der Neurologischen Klinik und Poliklinik des UKW die Rolle des Immunsystems bei der Parkinson-Erkrankung erforscht. Um Diagnose und Therapie zu verbessern, ist es wichtig, die an der Kommunikation zwischen Gehirn und Darm beteiligten Zellen zu identifizieren und ihre Wege zu verstehen.
Wichtige Informationen über αSyn-Transport zwischen Gehirn und Darm
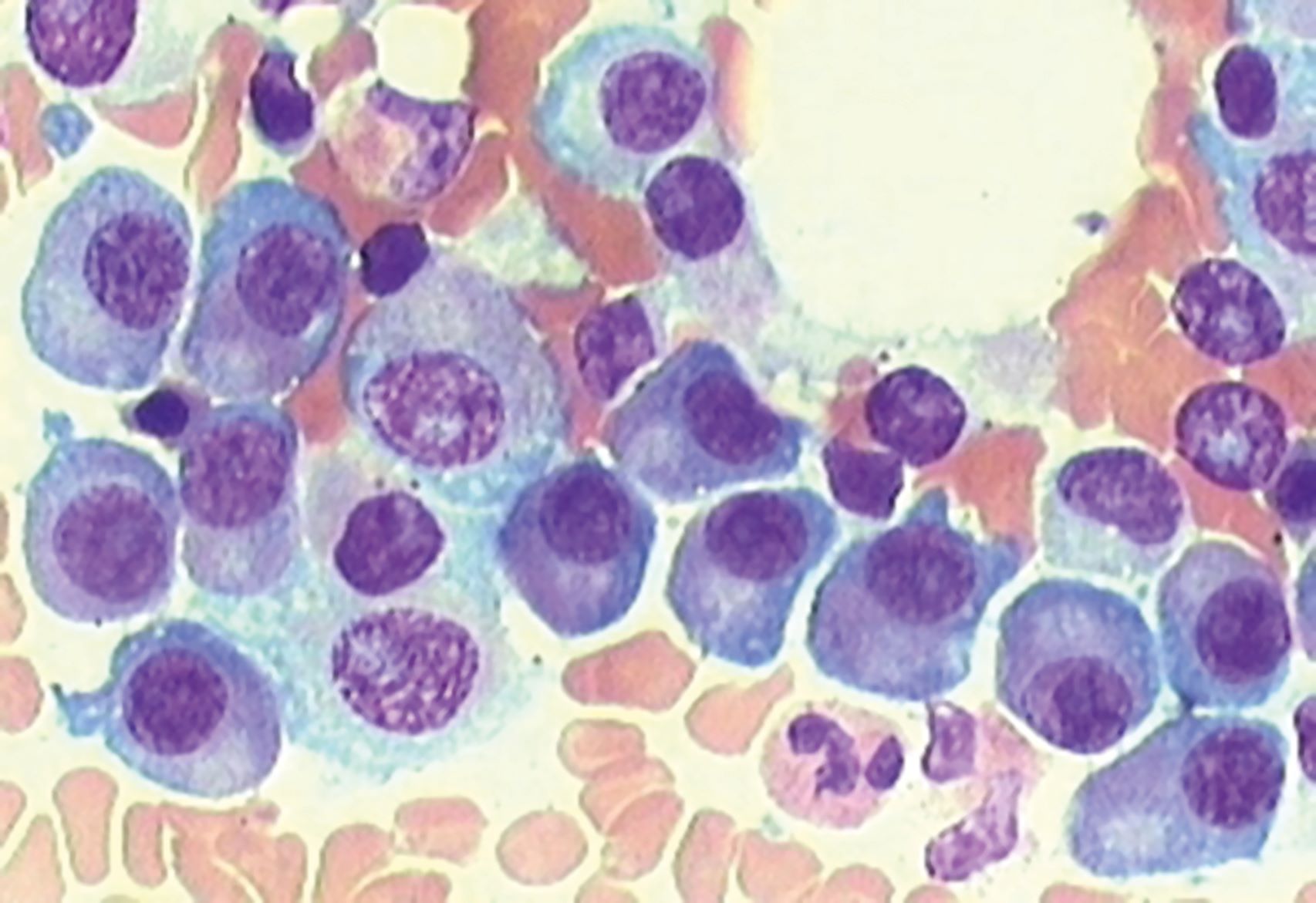
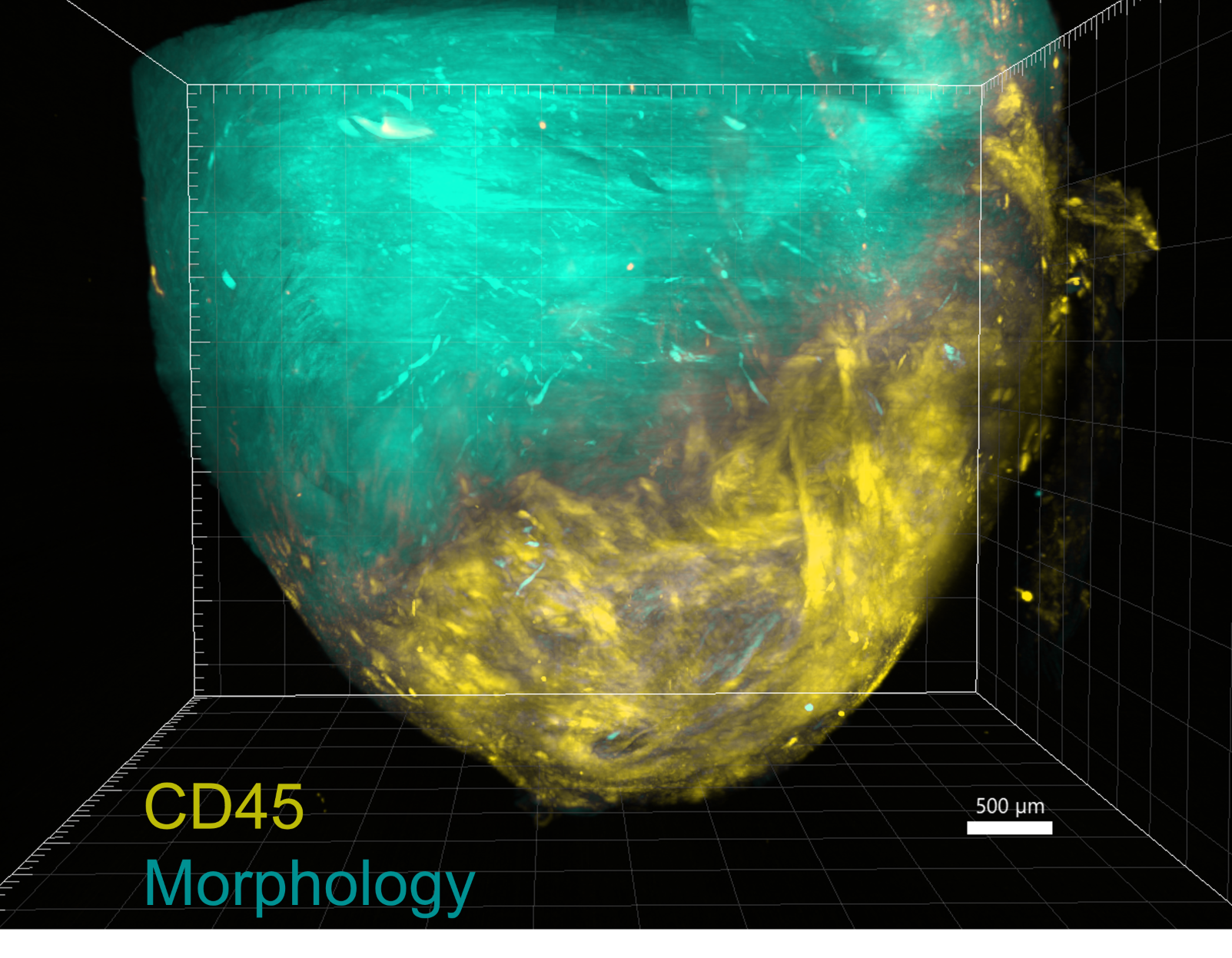
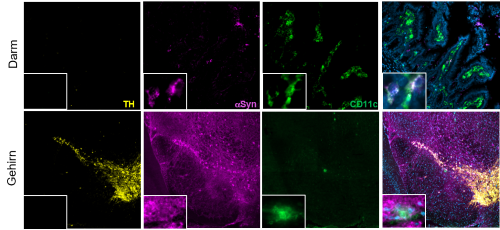
Bei der Parkinson-Krankheit spielt eine bestimmte Ansammlung des Proteins α-Synuclein (αSyn) eine Rolle. In einem Mausmodell für Parkinson entdeckten Rhonda McFleder und ihr Team, dass diese Proteine vom Gehirn in den Darm wandern und dort Störungen verursachen. Aber wie bewegen sich diese Proteine zwischen Gehirn und Darm? Interessanterweise fanden die Forscherinnen und Forscher diese Proteinansammlungen nicht in den Neuronen, die im Darm ein autonomes enterisches Nervensystem steuern, sondern in den Makrophagen. Makrophagen, auch Fresszellen genannt, sind Teil des Immunsystems und spielen eine wichtige Rolle bei der Abwehr von Krankheitserregern und der Beseitigung von Schadstoffen im Körper. Die Einzelzellsequenzierung zeigte, dass Gehirn und Darm eine identische Teilmenge wandernder Makrophagen enthalten, die in anderen Immunorganen wie der Milz fehlt.
Einzigartige Kommunikation zwischen Gehirn und Darm fördert Parkinson und andere neurologische Erkrankungen
„Um eindeutig zu testen, ob Makrophagen vom Gehirn in den Darm wandern, haben wir eine Methode entwickelt, mit der wir Zellen im Gehirn markieren und ihre Wanderung in andere Organe verfolgen können“, schildert Rhonda McFleder ihre Untersuchungen. „Unsere Ergebnisse deuten auf eine einzigartige Kommunikation zwischen Gehirn und Darm hin und lassen vermuten, dass diese Kommunikation an der Ausbreitung der Parkinson-Krankheit beteiligt ist.“ Prof. Dr. Chi Wang Ip, stellvertretender Klinikdirektor der Neurologischen Klinik und Poliklinik am UKW und Letztautor der Studie ergänzt eine weitere wichtige Entdeckung: „Wir haben gesehen, dass Makrophagen nicht nur bei Parkinson, sondern auch unter Kontrollbedingungen vom Gehirn in den Darm wandern, was den Befunden eine breitere Relevanz für andere neurologische Erkrankungen verleiht. So wie diese Zellen die Pathologie bei der Parkinson-Krankheit vorantreiben, können sie auch die Ausbreitung der Krankheit bei anderen neurologischen Erkrankungen fördern.“
Identifikation der Zellen bietet potenzielles therapeutisches Ziel
Wie geht es weiter? Der nächste Schritt bestehe Rhonda McFleder zufolge darin, diese wandernden Zellen vollständig zu charakterisieren und die sogenannten Homing-Moleküle zu identifizieren, welche diese Zellen in den Darm leiten. „Sobald wir diese Moleküle identifiziert haben, können wir Therapeutika entwickeln, die auf sie abzielen und hoffentlich den Krankheitsverlauf bei Parkinson und anderen neurologischen Erkrankungen aufhalten.“
Neben der Neurologischen Klinik und Poliklinik waren die Arbeitsgruppen von Janos Groh, Andreas Beilhack, Jörg Vogel, Antoine-Emmanuel Saliba, James Koprich, Jonathan Brotchie und Axel Pagenstecher an der Studie beteiligt. Das Projekt wurde unterstützt durch die Alexander von Humboldt-Stiftung (Stipendium Rhonda McFleder), das Bayerische Wirtschaftsministerium, die Deutsche Forschungsgemeinschaft (DFG), das Interdisziplinäre Zentrum für Klinische Forschung (IZKF) der Universität Würzburg, die Stiftung VERUM und das damalige EU-Förderprogramm für Forschung und Innovation Horizon 2020.
Publikation:
McFleder, R.L., Makhotkina, A., Groh, J. et al. Brain-to-gut trafficking of alpha-synuclein by CD11c+ cells in a mouse model of Parkinson’s disease. Nat Commun 14, 7529 (2023). https://doi.org/10.1038/s41467-023-43224-z
Porträt von Rhonda McFleder in der Serie #WomenInScience: