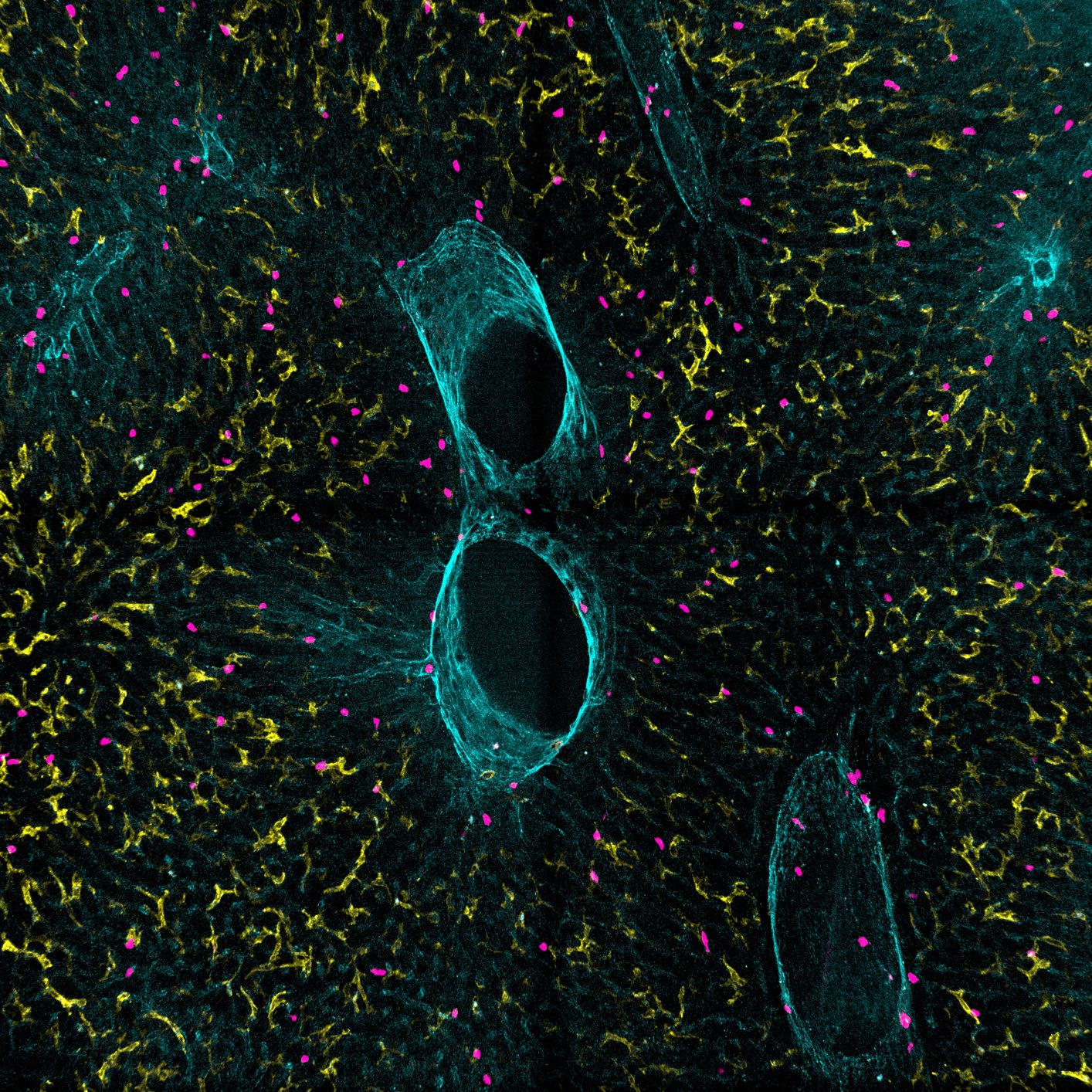
Würzburg, 4. Oktober 2023 – Wie es dem Coronavirus SARS-CoV-2 bei einer Infektion gelingt, seinen Vermehrungsmechanismus in Gang zu setzen, ist bislang noch nicht voll verstanden. Forschende vom Helmholtz-Institut Würzburg (HIRI) weisen jetzt im Fachmagazin „Cell“ erstmals nach, dass es das menschliche Protein SND1 ist, das im Zusammenspiel mit dem viralen Protein NSP9 die genetische Replikation des Virus stimuliert. Ebenfalls überraschte die Wissenschaftler:innen, dass NSP9 den Vermehrungsprozess antreibt, indem es als erster Baustein bei der Herstellung neuen viralen Erbguts fungiert. Die Erkenntnisse sind nicht nur bedeutend für die weitere Grundlagenforschung. Sie könnten auch neue Ansätze für die Behandlung von COVID-19 und anderen durch Coronaviren verursachten Infektionskrankheiten hervorbringen.
SARS-CoV-2, das Virus, das für die Infektionskrankheit COVID-19 mit weltweit bislang fast sieben Millionen Todesfällen (Statista/Worldometer) verantwortlich ist, hat ein charakteristisches genetisches Profil, das vollständig aus Ribonukleinsäure (RNA) besteht. Diese RNA enthält den Bauplan für die Herstellung neuer Viruskopien. Wenn SARS-CoV-2 eine Zelle infiziert, übernimmt es gewissermaßen den Maschinenraum dieser Wirtszelle, um sich selbst zu kopieren und so zu vermehren. Dabei werden verschiedene Arten von viraler RNA erzeugt, die jeweils eine spezifische Rolle im Replikationszyklus des Virus spielen.
In einer soeben im Fachmagazin „Cell“ veröffentlichten Studie des Würzburger Helmholtz-Instituts für RNA-basierte Infektionsforschung (HIRI), einem Standort des Braunschweiger Helmholtz-Zentrums für Infektionsforschung in Kooperation mit der Julius-Maximilians-Universität Würzburg, hat ein Team um Forschungsgruppenleiter Mathias Munschauer das Zusammenspiel verschiedener SARS-CoV-2-RNAs mit Proteinen der menschlichen Wirtszelle untersucht.
„Es ist mittlerweile viel über die Funktionen der SARS-CoV-2-Proteine bekannt. Wir wissen jedoch noch zu wenig darüber, wie die Proteine der infizierten menschlichen Zelle die Fähigkeit des Virus beeinflussen, sich zu vermehren“, erläutert Munschauer den Hintergrund der aktuellen Studie, deren leitender Autor er ist.
Nora Schmidt ist Postdoc im Labor von Mathias Munschauer und gehört zu den Erstautor:innen. „Wir haben entdeckt, dass ein Wirtsprotein namens SND1 einen spezifischen RNA-Typ erkennt, nämlich RNA mit negativer Polarität", sagt sie und ergänzt: „Negativ orientierte RNA dient als Vorlage für die Produktion und Vervielfältigung von neuer viraler RNA, ohne selbst in neue Proteine übersetzt zu werden.”
Update für die Corona-Lehrbücher
Es zeigte sich, dass SND1 im Vermehrungsprozess von SARS-CoV-2 eine entscheidende Rolle spielt: Einerseits erkennt es den Anfang der negativ orientierten RNA-Vorlage, die zur Virusreplikation benötigt wird. Andererseits interagiert dieses menschliche Protein auch mit einem viralen Protein namens NSP9.
Ebenfalls im Erstautorenteam ist Yuanjie Wei. „Unsere Forschung hat einen wesentlichen Mechanismus enthüllt“, freut sich die Doktorandin. „Stimuliert durch den menschlichen Faktor SND1, beginnt das Virus seine Replikation, wobei es sein eigenes Protein NSP9 als sogenannten Primer nutzt.“ Das bedeutet, dass NSP9 als erster Baustein eines wachsenden neuen RNA-Strangs fungiert.
Mit SND1 beschreiben die Autor:innen erstmals überhaupt ein Wirtsprotein, das negativ orientierte RNA erkennt. Erstmals konnten sie außerdem zeigen, dass die Bindung eines menschlichen Proteins an SARS-CoV-2-RNA und seine Interaktion mit NSP9 das Startsignal für die Virusreplikation setzt. Fehlt der Wirtsfaktor SND1, so ist dieser Startschuss beeinträchtigt und die Produktion viraler RNA weniger effizient.
Diese Erkenntnisse seien überraschend und Anlass zu einem Update der Lehrbücher, so das Team, zu dem auch Wissenschaftler:innen weiterer Forschungseinrichtungen in Deutschland und den USA zählten, darunter das Forschungsnetzwerk FOR-COVID und das Broad Institute von MIT und Harvard in Boston. Neben der Grundlagenforschung könnte die Medizin in Zukunft von neuen therapeutischen Angriffsmöglichkeiten profitieren. Zudem gibt es erste Hinweise darauf, dass seltene Varianten im SND1-Gen mit schweren COVID-19-Infektionen und Krankenhausaufenthalten in Verbindung stehen könnten.
Weitere Forschung ist hier nötig, ebenso zur Funktion von SND1 und NSP9 in anderen Coronaviren oder zum Beispiel zur Frage, ob das menschliche Protein SND1 auch bei der Vermehrung anderer respiratorischer RNA-Viren wie Influenza oder RSV (Respiratorisches Synzytial-Virus) eine Rolle spielt. Darüber hinaus müssen künftige Studien die genauen molekularen Eigenschaften aufklären, die die Bindung von SND1 an negativ orientierte RNA von SARS-CoV-2 oder anderen Coronaviren steuern.
Auf einen Blick
- Das virale Protein NSP9 startet als Primer die RNA-Synthese des Coronavirus SARS-CoV-2 in menschlichen Zellen – ein grundlegender Mechanismus, der bisher noch nicht bekannt war.
- Das Wirtsprotein SND1 stimuliert dieses Priming durch seine direkte Interaktion mit negativ orientierter viraler RNA und dem viralen Protein NSP9.
- SND1 ist für die Produktion neuer viraler RNA zu Beginn der Infektion erforderlich.
Förderung
Die Studie wurde aus Mitteln des Helmholtz Young Investigator Group-Programms, des Europäischen Forschungsrats (ERC) und des Forschungsnetzwerks FOR-COVID unterstützt. Nora Schmidt wurde außerdem über das EMBO Long-term Fellowship-Programm gefördert.
Originalpublikation
Schmidt N, Ganskih S, Wei Y, Gabel A, Zielinski S, (…) Munschauer M
SND1 binds SARS-CoV-2 negative-sense RNA and promotes viral RNA synthesis through NSP9
Cell, 3.10.2023, DOI: https://doi.org/10.1016/j.cell.2023.09.002
Video
Ein Begleitvideo zu dieser Medieninformation finden Sie auf YouTube.
Diese Medieninformation inkl. Video finden Sie auch auf unserer Website.
Helmholtz-Institut für RNA-basierte Infektionsforschung
Das Helmholtz-Institut für RNA-basierte Infektionsforschung (HIRI) ist die weltweit erste Einrichtung ihrer Art, die die Forschung an Ribonukleinsäuren (RNA) mit der Infektionsbiologie vereint. Auf Basis neuer Erkenntnisse aus seinem starken Grundlagenforschungsprogramm will das Institut innovative therapeutische Ansätze entwickeln, um menschliche Infektionen besser diagnostizieren und behandeln zu können.
Das HIRI ist ein Standort des Braunschweiger Helmholtz-Zentrums für Infektionsforschung (HZI) in Kooperation mit der Julius-Maximilians-Universität Würzburg (JMU) und befindet sich auf dem Würzburger Medizin-Campus.
Mehr unter www.helmholtz-hiri.de.
HIRI-Medieninformation (mit Video) vom 4. Oktober 2023