

Würzburg. Ihre Forschung kommt vielleicht nicht der breiten Masse zugute, aber: „Wenn ich dazu beitragen kann, dass eine Patientin oder ein Patient wieder laufen, atmen und leben kann, dann hat sich mein Einsatz gelohnt“, sagt Dr. Luise Appeltshauser, Assistenzärztin an der Neurologischen Klinik und Poliklinik des UKW. Das fand auch die Deutsche Gesellschaft für Muskelkranke e.V. (DGM) und zeichnete sie für ihre publizierte Arbeit zum Thema „Pan-Neurofascin assoziierte autoimmune Nodopathie“ auf dem DGKN-Kongress für Klinische Neurowissenschaften am 8. März 2024 in Frankfurt am Main mit dem Junior-Preis aus. Der mit 2.500 Euro dotierte Preis fördert die Erforschung neuromuskulärer Erkrankungen.
Autoimmune Nodopathien: Wenn Antikörper die Nervenknoten angreifen
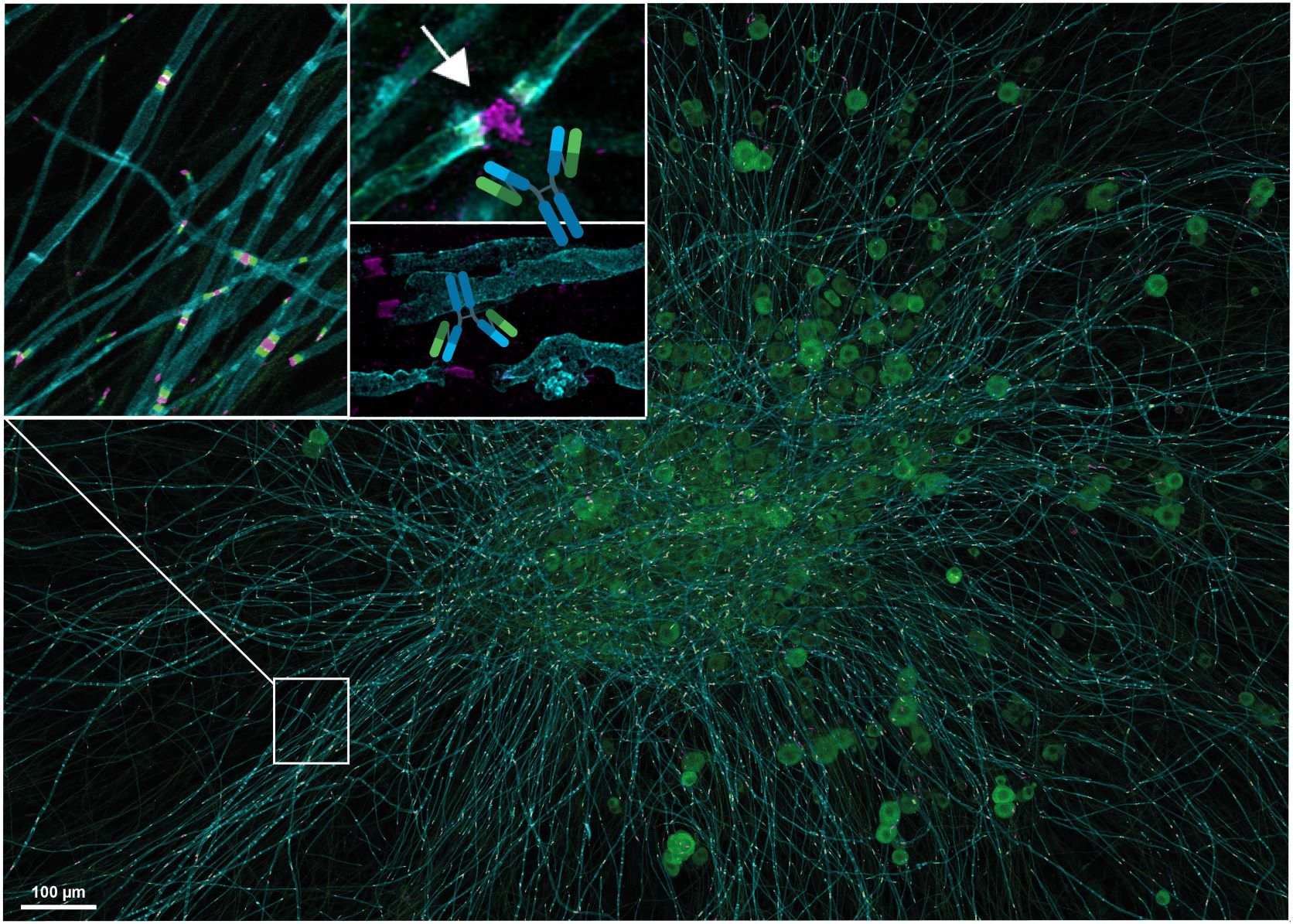
Luise Appeltshauser hat sich auf Autoimmunerkrankungen des Nervensystems spezialisiert, insbesondere auf die Autoimmune Nodopathie, eine seltene und schwere neuromuskuläre Erkrankung, die erst seit zehn Jahren bekannt ist. Bei der Autoimmunen Nodopathie greifen Antikörper die Nervenknoten, die so genannten Ranvierschen Schnürringen, entlang der Nervenfasern an. Diese Ranvierschen Schnürringe sind eine Art Turboboost, die dafür sorgen, dass die Signale vom Gehirn entlang der Nervenfaser schnell und effizient zum Ziel gelangen.
Proteine Neurofascin-186 und Neurofascin-155
An den Schnürringen befinden sich bestimmte Proteine, die von den Antikörpern attackiert werden. Nur wenige dieser Proteine sind bekannt. Luise Appeltshauser hat bereits während ihrer Doktorarbeit als Medizinstudentin in der Arbeitsgruppe von Privatdozentin Dr. Kathrin Doppler und leitender Oberärztin Prof. Dr. Claudia Sommer erstmals Antikörper gegen das Protein Caspr nachgewiesen. Im Fokus ihrer aktuellen Arbeit stehen nun die noch unerforschten Pan-Neurofascin-Antikörper. Diese Antikörper richten sich gegen die Proteine Neurofascin-186 und Neurofascin-155, die in der ultrakomplexen Struktur des Ranvierschen Schnürrings vorkommen. Luise Appeltshauser hat gemeinsam mit ihren Kolleginnen und den Doktorandinnen Helena Junghof und Julia Messinger Betroffene identifiziert, die klinischen Merkmale und das Therapieansprechen charakterisiert, den Pathomechanismus untersucht, also wie die Antikörper zur Schädigung führen, und neue Biomarker für die Diagnostik, den Verlauf und die Prognose ermittelt.
Zerfetzte Ranviersche Schnürringe und fulminanter Krankheitsverlauf
„Pan-Neurofascin-Antikörper können die Architektur der Schürringe regelrecht zerfetzen, was innerhalb weniger Wochen zu einem fulminanten Krankheitsverlauf führen kann“, erklärt die angehende Neurologin. „Häufig sind Männer im mittleren Alter betroffen. Die Betroffenen leiden unter Gefühlsstörungen und schweren Lähmungen der Gliedmaßen und Gesichtsnerven, können mitunter nicht mehr kommunizieren und müssen manchmal über Wochen und Monate künstlich beatmet werden. Komplikationen bei der Beatmung oder auch Herz-Rhythmusstörungen können dann sogar zum Tod führen.“ Das klinische Bild der Pan-Neurofascin-Autoimmun-Nodopathie unterscheide sich stark von den bereits bekannten Immun-Neuropathien. Die Diagnostik war bislang sehr schwierig, da keine Biomarker im Blut bekannt waren. Über den Antikörpernachweis lässt sich die Diagnose nun leicht stellen, ein weiterer Biomarker für den Verlauf kann der Gehalt an Neurofilament-Leichtketten im Serum sein. Eine frühzeitige Behandlung mit entsprechenden Medikamenten, die die Antikörper aus dem Blut eliminieren, sei aber immens wichtig, so Appeltshauser. Das Medikament Rituximab habe beispielsweise die Symptome erfolgreich reduziert und sogar zu Remissionen geführt.
32 Patientinnen und Patienten mit Pan-Neurofascin-Autoimmun-Nodopathie
Luise Appeltshauser und ihre Kolleginnen erhalten inzwischen Serumproben aus ganz Deutschland, aber auch aus den USA und Australien, um die Antikörper zu bestimmen. In der Literatur sind bis dato nur 32 Patientinnen und Patienten mit Pan-Neurofascin-Autoimmun-Nodopathie beschrieben, inklusive der von den Würzburger Neurologinnen untersuchten Erkrankten. Sie vermuten aber, dass es mehr solcher Antikörper-assoziierter Immun-Neuropathien gibt. Ihre Ursachen sind noch unklar. Ein möglicher Auslöser für die fehlgeleiteten Antikörper könnten frühere Infektionen sein. Die Fragestellungen gehen jedenfalls nicht aus.
Junior-Preis der DGM ist Ehre, Anerkennung, Rückenwind
„Der DGM-Junior-Preis gibt mir Rückenwind für zukünftige Forschungsprojekte“, freut sich Luise Appeltshauser. Er sei eine große Ehre und Anerkennung für die Zeit und das Herzblut, das sie in die Forschung gesteckt habe, und helfe bei weiteren Karriereschritten, zum Beispiel bei der Einwerbung von Drittmitteln und dem Aufbau einer eigenen Forschungsgruppe. Derzeit wird die Medizinerin vom Interdisziplinären Zentrum für Klinische Forschung (IZKF) der Medizinischen Fakultät der Universität Würzburg im Rahmen eines Habilitationsprogramms für Frauen gefördert. Zuvor war Luise Appeltshauser, die auch Sprecherin der Assistenzärztinnen und Assistenzärzte in der Neurologie am UKW ist, im Clinician Scientist-Programm des IZKF, das dem ärztlichen Nachwuchs neben der klinischen Ausbildung Freiräume für die Forschung gibt. Den Preis konnte sie aus gutem Grund nicht persönlich entgegennehmen: Vor vier Wochen hat Luise Appeltshauser ihr erstes Kind zur Welt gebracht.
Über die Deutsche Gesellschaft für Muskelkranke (DGM):
Die Deutsche Gesellschaft für Muskelkranke (DGM) mit Sitz in Freiburg ist mit rund 10.000 Mitgliedern die größte und älteste deutsche Selbsthilfeorganisation für Menschen mit neuromuskulären Erkrankungen. Seit über 50 Jahren fördert die DGM die Erforschung der mehr als 800 verschiedenen heute bekannten, teilweise sehr seltenen Muskelerkrankungen. Eine wichtige Aufgabe der DGM ist auch die Beratung und Unterstützung von Betroffenen und ihren Angehörigen in ihrem Alltag. Über Muskelerkrankungen zu informieren und die Interessen von muskelerkrankten Menschen gesundheitspolitisch zu vertreten, sind weitere zentrale Anliegen der Selbsthilfeorganisation.
Originalarbeiten
Appeltshauser L, Junghof H, Messinger J, et al. Anti-pan-neurofascin antibodies induce subclass-related complement activation and nodo-paranodal damage. Brain. 2023 May 2;146(5):1932-1949.
Appeltshauser L, Doppler K. Pan-Neurofascin autoimmune nodopathy - a life-threatening, but reversible neuropathy. Curr Opin Neurol. 2023 Oct 1;36(5):394-401.