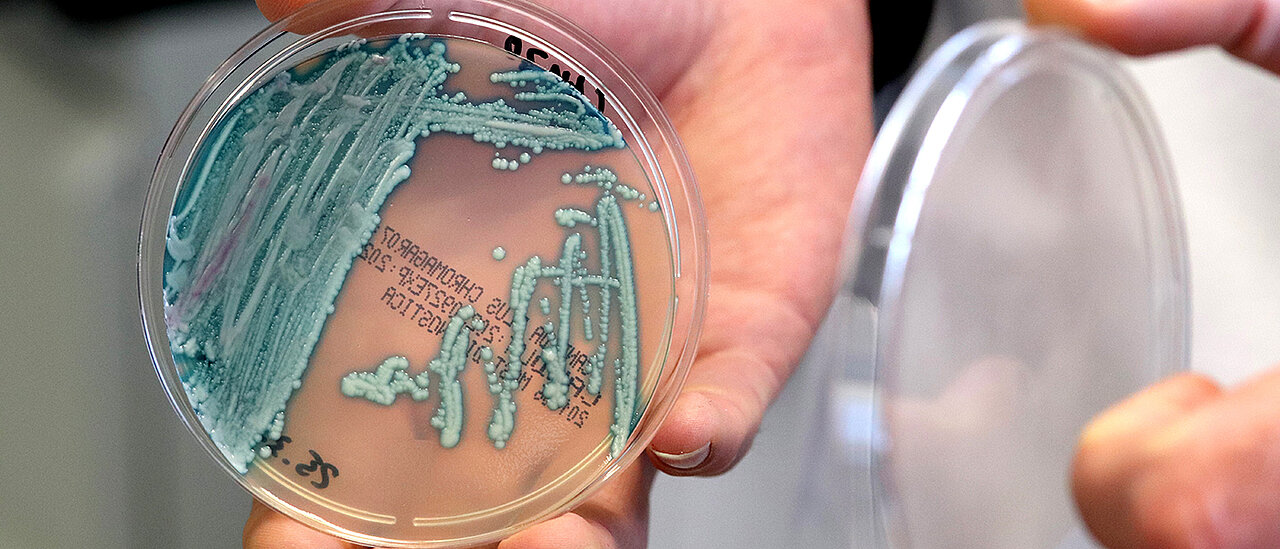
Würzburg. Vasc-on-Demand. Der Name ist Programm. In einem vom Europäischen Innovationsrat geförderten Projekt will Dr. Matthias Ryma mit seinem Team die Technologie zur einfachen Herstellung von Blutgefäßen in künstlichem Gewebe weiterentwickeln und kommerzialisieren. Blutgefäße auf Anbruf.
3D-Gewebemodelle spielen in der medizinischen Forschung eine immer größere Rolle. Ob Haut, Leber oder Muskeln - je nachdem, welche biologischen Zellen auf die Matrix aufgebracht werden, können Forscherinnen und Forscher verschiedene Krankheiten simulieren, um die Wirksamkeit von Therapien zu testen und die Entwicklung von Medikamenten zu beschleunigen. 3D-Gewebemodelle ermöglichen präzise Vorhersagen zur Reaktion auf Medikamente und helfen, Tierversuche zu reduzieren. Doch ohne funktionierende Mikroblutgefäße würden die im Labor hergestellten dreidimensionalen Gewebestrukturen absterben. Die Blutgefäße versorgen das Gewebe mit Sauerstoff und wichtigen Nährstoffen.
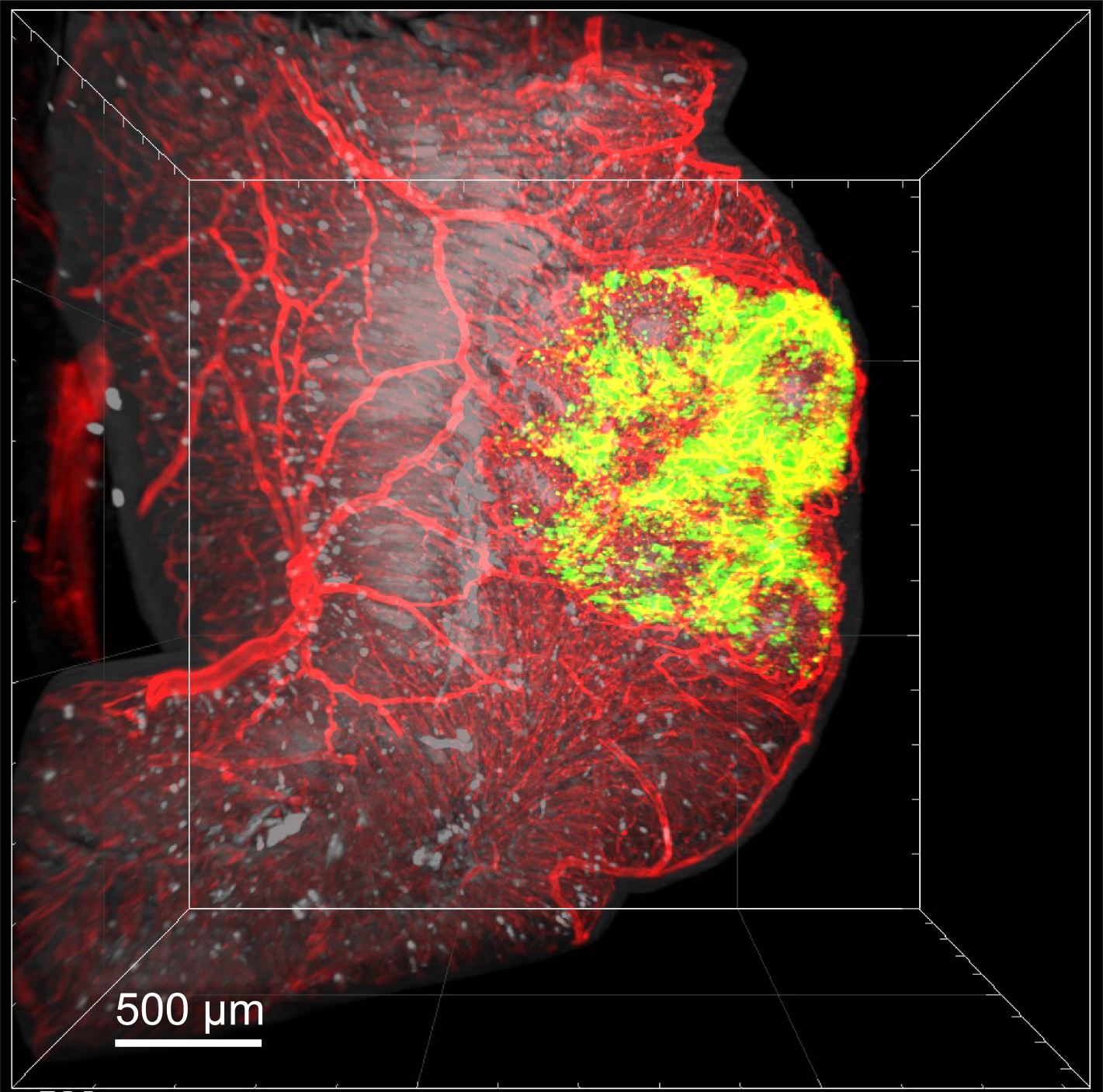
Thermorespensive Opferstrukturen zur Herstellung eines Mikrokanal-Netzwerks
„Die Mikroblutgefäße in die Gewebestrukturen zu integrieren, ist bis heute eine große Herausforderung“, weiß Matthias Ryma. Doch der Biologe kann helfen. Im Rahmen seiner mehrfach ausgezeichneten Doktorarbeit am Institut für Funktionsmaterialien und Biofabrikation des Universitätsklinikums Würzburg (UKW) hat Matthias Ryma ein Verfahren entwickelt und zum Patent angemeldet, mit dem er in einem hochauflösenden 3D-Drucker filigrane Fasern aus einem speziellen Polymer herstellen kann. Dieser in der Produktion aufwändige Druck dient als winziges Gerüst, auf dem der Wissenschaftler im Labor naturgetreue Blutgefäßstrukturen herstellen kann. „Wir betten die Faser in eine Gewebestruktur ein und lösen diese dann durch Temperatureinstellungen auf, so dass nur noch ein Kanal übrig bleibt. Wir opfern sozusagen die Faser und erhalten ein biomimetisches Mikrokanal-Netzwerk, das natürlichen Blutgefäßen ähnelt“, so Ryma. Je nach Forschungsfokus kann dann eine Matrix mit den entsprechenden Zellen auf das vaskularisierte Gewebe gegeben werden; die Zellen teilen und verteilen sich, und durch die permanente Nährstoff- und Sauerstoffzufuhr kann das Gewebe wachsen und reifen.
2,5 Millionen im Rahmen des Förderprogramms EIC Transition
Ein perfektes Projekt für das Förderprogramm EIC Transition, mit dem der Europäische Innovationsrat die Reifung und Validierung neuer Technologien sowie die Entwicklung eines Geschäftsmodells zur Markteinführung von Zukunftstechnologien unterstützt.
Das fünfköpfige Projektteam erhält insgesamt 2,5 Millionen Euro, um in den kommenden drei Jahren die Herstellung der Blutgefäße zu kommerzialisieren und ein Start-up-Unternehmen zu gründen. Im Mai 2024 fiel der Startschuss. Matthias Ryma leitet das Projekt und betreut die technische Entwicklung; die Chemikerin Katinka Theis schließt gerade in der Würzburger Biofabrikation ihre Doktorarbeit ab und wird sich um die Herstellung des Opfermaterials und der Matrix kümmern; Patrick Kuntschke wird als Kunststoffspezialist mit langjähriger Erfahrung in der Produktentwicklung zuständig für die Herstellung der Verbrauchsmaterialien sein; Alexander Radüchel ist ein erfahrener Projektleiter aus der Industrie mit wirtschaftswissenschaftlichem Hintergrund und wird im Projekt für das Projektmanagement sowie das Business Development tätig sein; komplettieren wird das Team in den nächsten Wochen eine Biologin, die sich um die biologische Testung und Etablierung des Prozesses kümmern wird.
„Zunächst werden wir einfach zu handhabendes Verbrauchsmaterial für die Herstellung von Blutgefäßen anbieten. Später sollen auch lebende künstliche Blutgefäße für den direkten Einsatz in Gewebemodellen zur Verfügung stehen“, erläutert Alexander Radüchel den Geschäftsplan.
Realistischere Simulation menschlichen Gewebes, beschleunigter Entwicklungsprozess und Reduzierung von Tierversuchen
Sowohl die Wissenschaft als auch die pharmazeutische Industrie werden von der erheblichen Zeit- und Kostenersparnis bei der Herstellung und Kultivierung reproduzierbarer vaskularisierter Gewebe profitieren, so Ryma. Die einfach zu handhabenden Produkte werden die 3D-Zellkultur für biologische Labors in Wissenschaft und Industrie zukünftig noch zugänglicher machen. Durch die Minimierung des Investitionsbedarfs können sich die Forschenden auf ihre 3D-gewebebasierte Forschung konzentrieren, anstatt Ressourcen für die Entwicklung der Gewebe selbst, zum Beispiel durch Bioprinting, aufzuwenden. Dies führt letztendlich zu einer schnelleren Generierung von Forschungsergebnissen, was langfristig die Entwicklung neuer Medikamente beschleunigt – und verbessert.
„Derzeit werden noch jährlich 2 Millionen Tiere für pharmazeutische Tests verwendet. Die meisten der an Tieren getesteten Medikamente sind aber nicht auf die Physiologie des Menschen übertragbar“, berichtet Matthias Ryma. „Biomimetische vaskularisierte Gewebemodelle, die auf menschlichem Gewebe basieren reduzieren also nicht nur Tierversuche, sondern auch falsch positive Ergebnisse.“
Prof. Dr. Jürgen Groll, Leiter des Instituts für Funktionsmaterialien und Biofabrikation am UKW ist stolz auf seinen ehemaligen Doktoranden und dessen Translation, dass er mit seiner anwendungsorientierten Forschung nun realistisch in die Firmengründung gehen kann: „Start-ups sind unser erklärtes Ziel. Und das Team hat es geschafft, die erste EIC Transition-Förderung für die Biofabrikation und fürs UKW einzuwerben. Das ist schon eine tolle Sache.“
Vorhergehende Studie zur Nutzung thermoresponsiver Opferstrukturen zur Herstellung perfusionsfähiger Gewebe in Bioreaktoren: M. Ryma, H. Genç, A. Nadernezhad, I. Paulus, D. Schneidereit, O. Friedrich, K. Andelovic, S. Lyer, C. Alexiou, I. Cicha, J. Groll, A Print-and-Fuse Strategy for Sacrificial Filaments Enables Biomimetically Structured Perfusable Microvascular Networks with Functional Endothelium Inside 3D Hydrogels. Adv. Mater. 2022, 34, 2200653. https://doi.org/10.1002/adma.202200653
Text: Kirstin Linkamp / UKW