Vitamin B6 ist wichtig für den Stoffwechsel im Gehirn. Dementsprechend ist ein niedriger Vitamin-B6-Spiegel bei verschiedenen psychischen Erkrankungen mit zahlreichen Störungen assoziiert – beispielsweise mit einer Beeinträchtigung des Gedächtnisses und des Lernvermögens, aber auch mit depressiven Verstimmungen bis hin zu einer echten Depression. Bei älteren Menschen sind niedrige Vitamin B6-Spiegel mit Gedächtnisverlust und Demenz verbunden.
Obwohl diese Beobachtungen zum Teil bereits vor Jahrzehnten gemacht wurden, ist die genaue Rolle von Vitamin B6 bei psychischen Erkrankungen noch weitgehend unklar. Klar ist jedoch: Eine verstärkte Aufnahme von Vitamin B6 allein, beispielsweise in Form von Nahrungsergänzungsmitteln, scheint nicht auszureichen, um Störungen der Gehirnfunktion zu verhindern oder zu behandeln.
Publikation in eLife
Ein Forschungsteam der Würzburger Universitätsmedizin hat jetzt einen anderen Weg entdeckt, über den der Vitamin-B6-Spiegel in Zellen effektiver erhöht werden kann: nämlich über die gezielte Hemmung seines intrazellulären Abbaus. Verantwortlich dafür ist Antje Gohla, Professorin für Biochemische Pharmakologie am Lehrstuhl für Pharmakologie und Toxikologie der Julius-Maximilians-Universität Würzburg (JMU).
Weitere Beteiligte kommen vom Rudolf-Virchow-Zentrum für integratives und translationales Bioimaging der JMU, dem Leibniz-Forschungsinstitut für Molekulare Pharmakologie-FMP Berlin und vom Institut für Klinische Neurobiologie des Würzburger Universitätsklinikums. In der Fachzeitschrift eLife hat das Team jetzt die Ergebnisse seiner Untersuchungen veröffentlicht.
Enzymblockade verbessert Lernvermögen
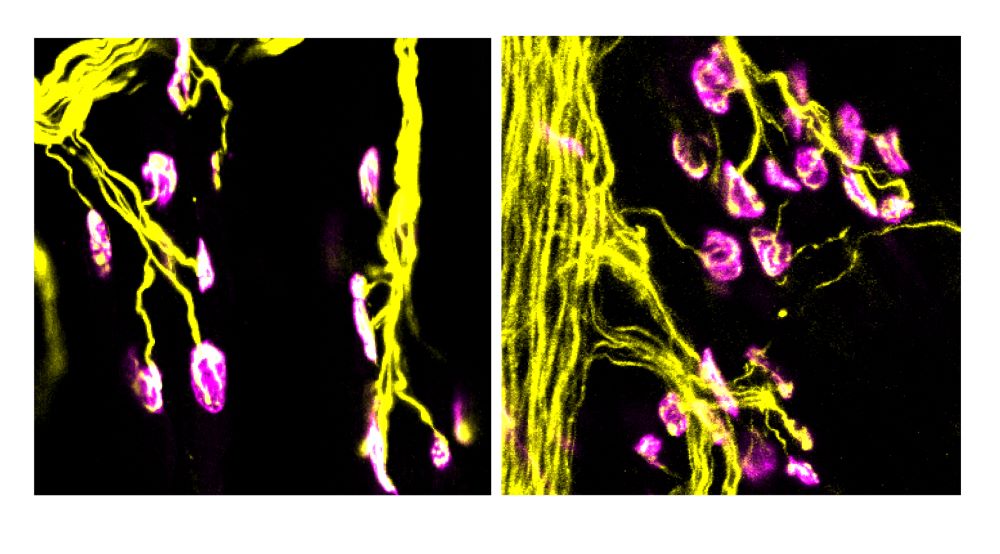
„Wir konnten bereits in früheren Arbeiten zeigen, dass das gentechnische Ausschalten des Vitamin-B6-abbauenden Enzyms Pyridoxal-Phosphatase in der Maus das räumliche Lern- und Erinnerungsvermögen der Tiere verbessert“, erklärt Antje Gohla. Um zu untersuchen, ob derartige Effekte auch durch pharmakologische Wirkstoffe erzielt werden können, haben die Wissenschaftlerinnen und Wissenschaftler nun nach Substanzen gesucht, die Pyridoxal-Phosphatase binden und hemmen.
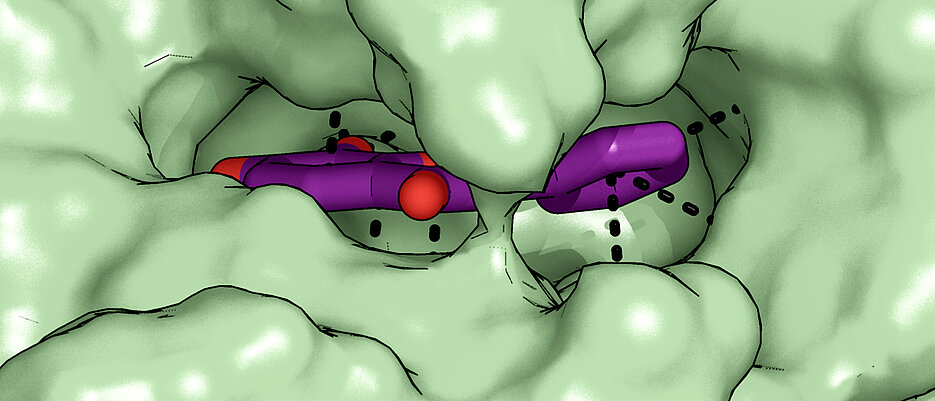
Mit Erfolg: „Wir haben in unseren Experimenten einen Naturstoff identifiziert, der die Phosphatase hemmen und damit den Abbau von Vitamin B6 verlangsamen kann“, erklärt die Pharmakologin. Tatsächlich konnte die Arbeitsgruppe damit die Vitamin-B6-Spiegel in Nervenzellen erhöhen, die an Lern- und Gedächtnisprozessen beteiligt sind. Der Name dieses Naturstoffes: 7,8-Dihydroxyflavon.
Neuer Ansatz für eine medikamentöse Therapie
7,8-Dihydroxyflavon wurde schon in zahlreichen anderen wissenschaftlichen Arbeiten als ein Molekül beschrieben, das Lern- und Merkprozesse in Krankheitsmodellen für psychische Störungen verbessern kann. Mit dem neuen Wissen um seine Wirkung als Hemmstoff der Pyridoxal-Phosphatase eröffnen sich nun neue Erklärungsansätze für die Wirksamkeit dieser Substanz. Dies könnte das mechanistische Verständnis psychischer Störungen verbessern und einen neuen medikamentösen Ansatz für die Behandlung von Erkrankungen des Gehirns darstellen, schreiben die Wissenschaftlerinnen und Wissenschaftler in ihrer Studie.
Dass es überhaupt erstmals gelungen ist, mit 7,8-Dihydroxyflavon einen Inhibitor der Pyridoxal-Phosphatase zu identifizieren, wertet das Team darüber hinaus als großen Erfolg – schließlich gelte diese Klasse von Enzymen als ganz besonders herausfordernd für die Wirkstoffentwicklung.
Ein weiter Weg bis zum Medikament
Wann werden Menschen von dieser Entdeckung profitieren? „Das lässt sich jetzt noch nicht sagen“, erklärt Marian Brenner, ein Erstautor der Studie. Allerdings spreche viel dafür, dass es vorteilhaft sein könnte, Vitamin B6 bei verschiedenen psychischen Störungen und neurodegenerativen Erkrankungen in Kombination mit Hemmstoffen der Pyridoxal-Phosphatase einzusetzen.
Dafür wollen Gohla und ihr Team nun in einem nächsten Schritt verbesserte Substanzen entwickeln, die dieses Enzym präzise und hochwirksam inhibieren. Mit solchen Hemmstoffen könne dann gezielt getestet werden, ob die Erhöhung zellulärer Vitamin-B6-Spiegel bei psychischen oder neurodegenerativen Erkrankungen hilfreich ist.
Publikation
7,8-Dihydroxyflavone is a direct inhibitor of human and murine pyridoxal phosphatase. Marian Brenner, Christoph Zink, Linda Witzinger, Angelika Keller, Kerstin Hadamek, Sebastian Bothe, Martin Neuenschwander, Carmen Villmann, Jens Peter von Kries, Hermann Schindelin, Elisabeth Jeanclos, and Antje Gohla. eLife, https://doi.org/10.7554/eLife.93094.3
Kontakt
Prof. Dr. Antje Gohla, Lehrstuhl für Pharmakologie und Toxikologie, T: +49 931 31-80099, antje.gohla@ uni-wuerzburg.de
Pressemitteilung der Universität Würzburg vom 13.06.2024