Welche Rolle spielt das durch den Nervenwachstumsfaktor (NGF) induzierte axonale Signaling – insbesondere von Interleukin-7 (IL-7) – bei der Entstehung und Auflösung von chronischen postoperativen Schmerzen (CPSP) nach einer abdominalen Hernienoperation? Im Rahmen dieses Projekts möchten wir Mechanismen identifizieren, die sich therapeutisch nutzen lassen, um das Schmerzmanagement nach Operationen zu verbessern.
Hintergrund
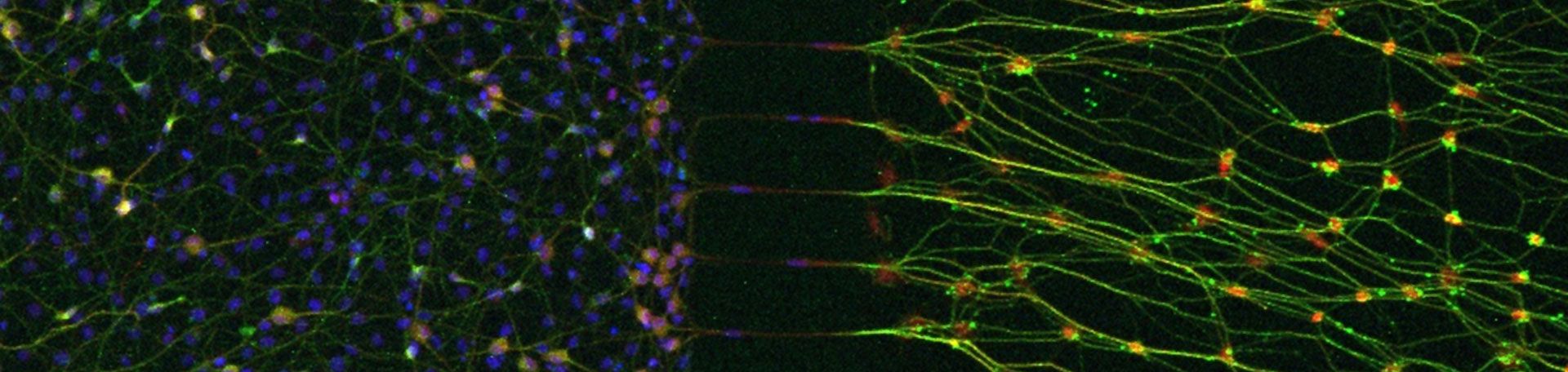
Chronische postoperative Schmerzen sind eine häufige Komplikation nach abdominalen Operationen; über 50 Prozent der Patientinnen und Patienten sind nach Hernienoperationen betroffen. NGF ist ein Schlüsselmolekül, das früh nach Gewebeschäden freigesetzt wird und Nozizeptoren sensibilisiert sowie Schmerzpfade moduliert. Während die Effekte von NGF auf die Zellkörper sensorischer Neurone gut beschrieben sind, ist die Wirkung in distalen Nervenendigungen weitgehend unerforscht. Erste Ergebnisse zeigen, dass NGF die Expression von IL-7 in Axonen induziert, was zur Rekrutierung von Neutrophilen an die Wundstelle führt. Diese Ansammlung von Neutrophilen spielt eine doppelte Rolle: sie unterstützt die Wundheilung, könnte aber auch die Schmerzpersistenz fördern.
Forschungsziel
Wir wollen untersuchen, wie das NGF-induzierte IL-7-Signaling an peripheren Nervenendigungen die Rekrutierung von Neutrophilen, die Neuroinflammation und die Schmerzauflösung nach Laparotomie reguliert.
Bedeutung für Patientinnen und Patienten
Durch die Aufklärung der Rolle des NGF-IL-7-Signalings bei postoperativen Schmerzen könnte dieses Projekt den Weg für neue therapeutische Ansätze ebnen, die CPSP verhindern. Eine Begrenzung der IL-7-vermittelten Neutrophilen-Rekrutierung könnte eine gezielte Strategie darstellen, um die Schmerzauflösung zu fördern und die postoperative Erholung bei Patient:innen nach abdominalen Eingriffen zu verbessern.
Forschungsteam NP8
Leitung
PD Dr. rer. nat. Michael Briese
Institut für Klinische Neurobiologie
Universitätsklinikum Würzburg
Prof. Dr. med. Nana-Maria Wagner
Stellvertretende Klinikdirektorin der Klinik für Anästhesiologie, Intensivmedizin, Notfallmedizin und Schmerztherapie
Universitätsklinikum Würzburg
Mitarbeiterinnen und Mitarbeiter im Team
Ankita Rawat, Doktorandin



