Studienergebnisse
Sunitinib hilft bei bösartigen Tumoren
Paragangliome sind Stresshormonproduzierende Tumore, die im Bauch-, Brust-, und Kopf-Hals-Bereich auftreten können. Wenn sie in der Nebenniere entstehen, werden sie Phäochromozytome genannt. Die Tumore sind selten, meist gutartig und können gut behandelt werden. „Bei einem malignen, progredienten Phäochromozytom und Paragangliom hingegen, das durch Metastasen gekennzeichnet ist und jedes Jahr bei etwa 50 Personen in Deutschland neu diagnostiziert wird, überlebt nur jeder zweite Erkrankte die folgenden fünf Jahre“, berichtet Prof. Dr. Martin Fassnacht, Leiter des Lehrstuhls Endokrinologie und Diabetologie am UKW. Eine effektive Standardtherapie gab es bislang nicht. Doch die vom UKW maßgeblich mitkoordinierte Studie FIRST-MAPPP (First International Randomised Study in MAlignant Progressive Phaeochromocytoma and Paraganglioma) lieferte erstmals die Evidenz, dass der Multityrosinkinase-Inhibitor Sunitinib eine wichtige neue Therapieoption ist. Sunitinib blockiert mehrere molekulare Angriffspunkte, die am Wachstum und der Ausbreitung von verschiedenen Tumoren beteiligt sind. Die Auswertung der Studie, die von Prof. Dr. Eric Baudin vom französischen Institut Gustave Roussy gemeinsam mit Prof. Fassnacht geleitet wurde, erschien im Februar dieses Jahres im renommierten Journal The Lancet.

PET/CT-Aufnahme eines Patienten mit einem metastasiertem Phäochromozytom: Neben der natürlichen Traceranreicherung in Leber, Milz, Nieren und Harnblase zeigen die gelb-weißen Areal Metastasen im Skelettsystem.
Studienergebnisse
Tumor-on-Chip: Neue Möglichkeiten für die personalisierte Medizin
Mit der Tumor-on-Chip-Technologie wird patienteneigenes Tumorgewebe außerhalb des Körpers gezüchtet, um die Wirksamkeit und Sicherheit neuer Therapieansätze zu bewerten.
Wie reagiert ein Tumor auf eine bestimmte Therapie? Dies bereits vor Beginn der Behandlung zu wissen, wäre für Krebskranke sowie die behandelnden Ärztinnen und Ärzte von großem Wert. Für die CAR-T-Zelltherapie haben Forschende des UKW, des Fraunhofer Instituts für Zelltherapie und Immunologie mit seiner Außenstelle Würzburg und des Universitätsklinikums Tübingen nun genau diese Beobachtung möglich gemacht – in Echtzeit und am Tumorgewebe der Erkrankten. Dazu wurde die Tumor-on-Chip-Technologie eingesetzt. Der Begriff beschreibt hier ein auf menschlichen Zellen basierendes komplexes In-vitro-System eines Brustkrebstumors, in dem Tumorgewebe außerhalb des Körpers gezüchtet wurde. Die Wissenschaftlerinnen und Wissenschaftler bildeten dabei nicht nur die 3D-Mikroumgebung des Tumors nach, sondern ermöglichten auch das Durchströmen des Chips mit einem künstlichen Blutersatz. Über diesen wurden den Tumorzellen auch die CAR-T-Zellen zugeführt und ihre Wirkung direkt beobachtet. „Damit können wir individuell untersuchen, wie genau diese Tumorzellen auf die geplante Therapie reagieren, mit welchen Nebenwirkungen möglicherweise zu rechnen ist und wie diese direkt verringert werden können“, schildert Dr. Miriam Alb, Projektleiterin am Lehrstuhl für Zelluläre Immuntherapie der Medizinischen Klinik II des UKW. Die Entwicklung wurde im April 2024 im Journal Cell Stem Cell veröffentlicht.
Neue Studien
ERC Advanced Grant für die Erforschung von Thrombozyten
Blutplättchen, in der Fachsprache Thrombozyten genannt, können viel mehr als Blutungen stillen und Infarkte auslösen. Als Modulatoren des Immunsystems treiben sie auch Entzündungsprozesse voran und begünstigen so Gewebeschädigungen. Prof. Dr. Bernhard Nieswandt, Leiter des Lehrstuhls für Experimentelle Biomedizin I am UKW und Forschungsgruppenleiter am Rudolf-Virchow-Zentrum der Uni Würzburg, war an diesen Erkenntnissen maßgeblich beteiligt und prägt den Begriff „Thrombo-Inflammation“. Für seine Pionierarbeit in der Blutplättchenforschung, seine neueste Entdeckung und weiterführende Untersuchungen wurde er jetzt mit einem ERC Advanced Grant in Höhe von 2,5 Millionen Euro ausgezeichnet. Die Advanced Grants des European Research Councils (ERC) sind Teil des EU-Programms Horizon Europe und richten sich an etablierte Spitzenforscherinnen und -forscher. Abgespaltene Organellen, die Immunfunktionen steuern Der Preis ist für Prof. Nieswandt Anerkennung und Ansporn zugleich, weiter seinem wissenschaftlichen Instinkt zu folgen, am Puls der Zeit zu forschen und Durchbrüche in dem Verständnis von Erkrankungen wie Schlaganfall, Blutvergiftung (Sepsis) oder akutem Lungenversagen (ARDS) zu erzielen. Bei der Entstehung dieser Erkrankungen spielen Thrombozyten nämlich eine maßgebliche Rolle. Und um die geht es auch im neuen ERC-Projekt PITT-Inflame, ein Akronym für „Platelet-derived Integrin- and Tetraspanin-enriched Tethers as key effectors in thrombo-Inflammation“. PITTs sind kometenschweifartige, von Thrombozyten abgespaltene Organellen, die mit anderen Zellen im Gefäßsystem interagieren und so Entzündungen vorantreiben. „Unsere Hypothese ist, dass zirkulierende Thrombozyten die Fähigkeit haben, ihre wichtigsten Adhäsions- und Signalisierungsmechanismen auf zwei grundlegend verschiedene Arten zu nutzen und dadurch zwischen hämostatischen und thrombo-inflammatorischen Funktionen zu wechseln. Sollte sich diese Annahme bestätigen, würde dies eine grundlegend neue Forschungsrichtung in der Thrombozytenbiologie begründen und vielversprechende Wege für die Behandlung eines breiten Spektrums von Krankheiten mit großen Auswirkungen auf die Gesellschaft eröffnen“, fasst Nieswandt zusammen.
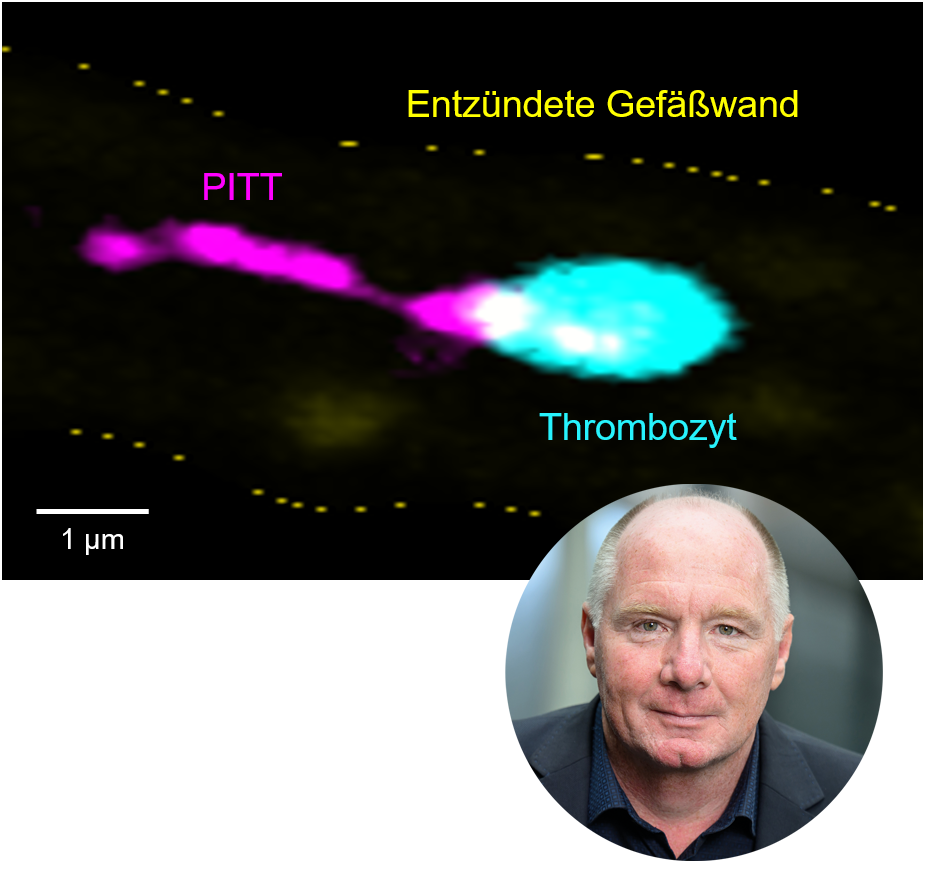
Prof. Dr. Bernhard Nieswandt und ein Beispiel für die von ihm entdeckten PITTs.

Neue Studien
Leitung bei internationalem Myelom-Workshop
Ende März veranstaltete die Internationale Myelom-Gesellschaft in Boston/USA ihren fünften Workshop über Immuneffektor-Zelltherapien beim Multiplen Myelom. Organisiert und geleitet wurde das zweitägige Treffen zum fünften Mal in Folge vom Direktor der Medizinischen Klinik II des UKW, Prof. Dr. Hermann Einsele, gemeinsam mit zwei US-amerikanischen Kollegen. „Das tolle Programm lockte mehr als 500 Teilnehmerinnen und Teilnehmer an“, berichtet Einsele und fährt fort: „Das UKW war mit insgesamt vier Vorträgen hervorragend vertreten. Vor allem der Beitrag von Dr. Sophia Danhof zu neuen Zielstrukturen auf den Myelomzellen wurde sehr positiv aufgenommen und intensiv diskutiert.“
Von links: Keynote-Speaker Dr. Stanley Riddell mit Prof. Dr. Michael Hudecek und Prof. Dr. Hermann Einsele (beide UKW) beim 5th Immune Effector Cell Therapies in Multiple Myeloma Workshop in Boston/USA.
Bild: Tengku Ibrahim Maulana / Eberhard Karls Universität Tübingen / Daniel Peter