
Hatte schon der Neandertaler eine Fettleber?
Ein gemeinsames Forschungsprojekt der Universitätskliniken Würzburg und Homburg sowie des Max-Planck-Instituts für evolutionäre Anthropologie in Leipzig ermöglicht neue Einblicke in die evolutionären Grundlagen der Fettlebererkrankung.
Nicht nur Umweltfaktoren wie Überernährung und Bewegungsmangel, sondern auch genetische Veranlagungen können eine Fettleber verursachen. Eine relevante Rolle spielt die häufige Variante rs738409 des PNPLA3-Gens. Wie kommt es zu der auffallend heterogenen globalen Präsenz dieses Risiko-Allels? Wo liegt der Ursprung der PNPLA3-Variante rs738409? Diese Fragen beschäftigten Prof. Dr. Andreas Geier, Leiter der Hepatologie am UKW, schon länger. Gemeinsam mit Stephan Schiffels, Leiter der Arbeitsgruppe Populationsgenetik am Max-Planck-Institut für evolutionäre Anthropologie in Leipzig, Prof. Dr. Marcin Krawczyk vom Universitätsklinikum des Saarlandes sowie dessen Doktoranden Jonas Trost analysierte er die DNA von mehr als 10.000 archaischen und modernen Menschen aus aller Welt. Darunter waren unter anderem die Genome von Neandertalern und zwei Denisova-Menschen. „Überraschenderweise trugen alle archaischen Menschen, die vor 40.000 bis 65.000 Jahren lebten, ausschließlich das Risiko-Allel, was auf eine Fixierung des Varianten-Allels bei ihren gemeinsamen Vorfahren hindeutet“, erklärt Prof. Geier.
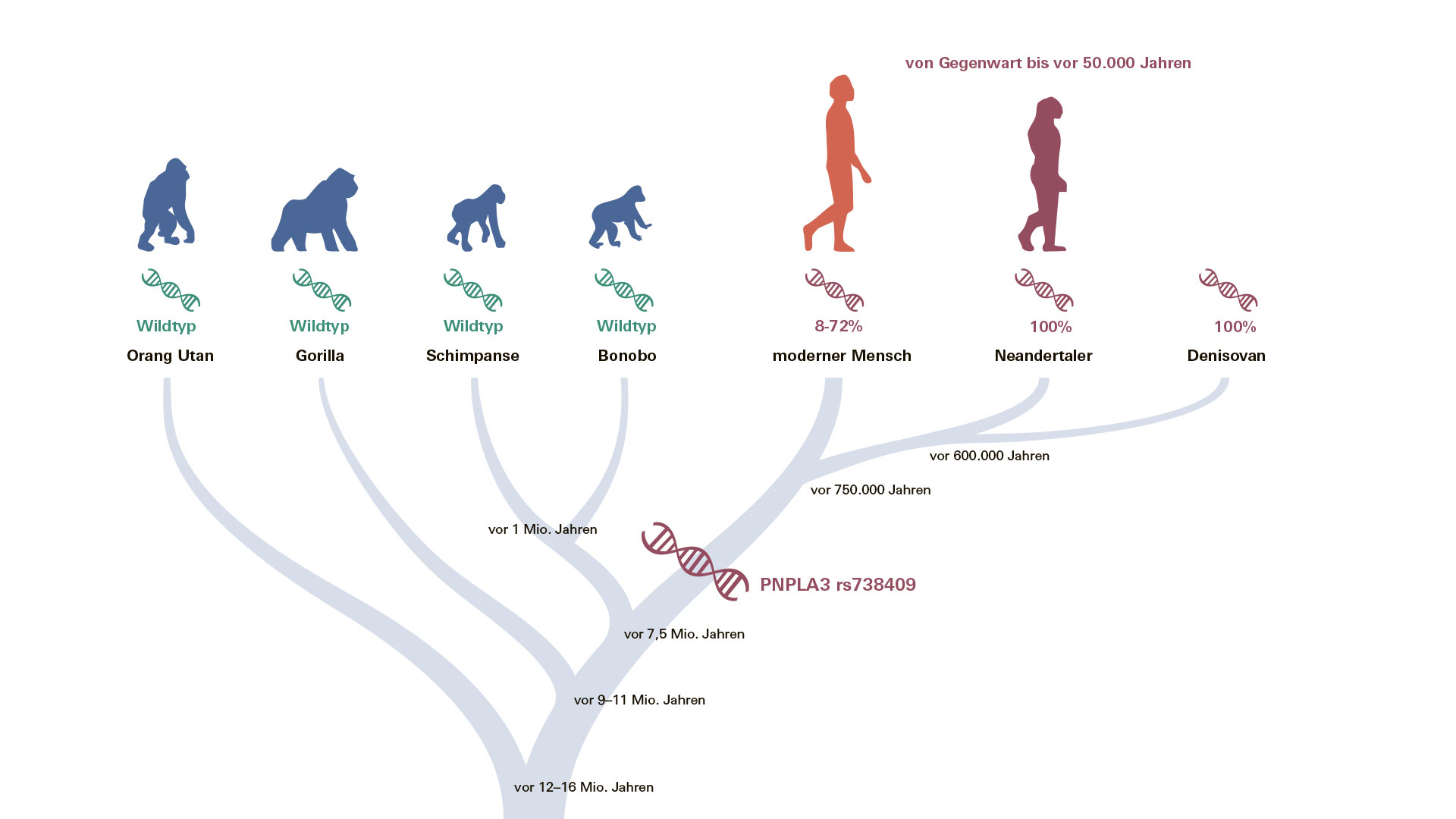
Vorhandensein der PNPLA3 rs738409-Genvariante bei modernen und archaischen Menschen, wobei die großen Menschenaffen die ursprüngliche Variante, den Wildtyp, tragen.
Fettspeicherung sicherte einst das Überleben Daraus schließen die Wissenschaftler, dass die Hauptvariante des Fettleber-Gens PNPLA3 bereits vor der Aufspaltung des menschlichen Stammbaums vor mehr als 700.000 Jahren entstanden sein muss (siehe Bild). Aber warum? Schließlich hat diese Variante ungünstige gesundheitliche Auswirkungen. Eine Hypothese ist, dass diese und andere Genvarianten, die am Stoffwechsel beteiligt sind, in der Altsteinzeit entwickelt wurden, um das Überleben zu sichern. „Insbesondere die Fähigkeit, Fett zu speichern, war wahrscheinlich während des größten Teils der Menschheitsgeschichte von Vorteil, während sie unter den heutigen Lebensbedingungen von Nachteil ist“, erklärt Geier. PNPLA3 wird auch in der Netzhaut exprimiert. Hier ist es am Stoffwechsel von Vitamin A beteiligt, das das Sehen in der Dämmerung beeinflusst – möglicherweise ein wichtiger Aspekt bei der Jagd. Außerdem kommt es im braunen Fettgewebe vor. „Unsere Beobachtung könnte den Vorteil der Fettspeicherung in kaltem Klima und insbesondere für Neandertaler unter eiszeitlichen Bedingungen unterstreichen“, spekuliert Geier. Haben wir das Fettleber-Gen von den Neandertalern geerbt? Ob wir die PNPLA3-Variante rs738409 von den Neandertalern geerbt haben, ist eine der zentralen Fragen, die sich aus der Studie ergibt. Und sie ist nicht ganz unbegründet. So wurde die Genvariante SLC16A11, die unter anderem zu Diabetes Mellitus führt, von den Neandertalern auf die modernen Menschen übertragen, aber nicht an alle. Der Homo neanderthalensis lebte bereits in Europa als der Homo sapiens aus Afrika kam und ein Genaustausch stattfand. In Afrika findet man SLC16A11 nicht, dafür aber Varianten von PNPLA3. Und das spricht gegen einen Gentransfer durch den Neandertaler. „Obwohl er dazu beigetragen haben könnte“, fügt Stephan Schiffels hinzu. „Tatsächlich zeigen unsere nachfolgenden Analysen, dass eines von 1.000 heutigen PNPLA3-Varianten-Allelen aus dem Neandertaler-Genom stammen könnte.“ Die mit finanzieller Unterstützung des European Research Council im EU-Forschungsrahmenprogramm Horizon 2020 gewonnenen Erkenntnisse wurden im März 2024 im Fachjournal für Gastroenterologie und Hepatologie Gut publiziert.
Von Hautzellen über Stammzellen zu Nervenzellen
Prof. Dr. Nurcan Üçeyler und ihrem Team vom UKW ist es gelungen, aus Hautzellen von Patientinnen und Patienten mit Morbus Fabry Stammzellen herzustellen und diese in sensible Nervenzellen umzuwandeln. Mit diesen patienteneigenen Nervenzellen konnten die Forschenden neue molekulare und funktionelle Erkenntnisse über die Stoffwechselerkrankung gewinnen.
Bei der seltenen Stoffwechselerkrankung Morbus Fabry ist die Übertragung von Signalen wie Schmerz oder Temperatur durch einen Gendefekt gestört. Bei den Betroffenen funktioniert das lebenswichtige lyosomale Enzym Alpha-Galaktosidase A nur noch teilweise oder gar nicht mehr. Dadurch können bestimmte Abfallprodukte in den Zellen nicht ausreichend abgebaut und entsorgt werden. Die Folge ist, dass sich vor allem Fettverbindungen, so genannte Sphingolipide, in den Nervenzellen, aber auch in anderen Zellen im ganzen Körper anreichern. Neben dem Nervensystem werden vor allem Organe wie Herz und Nieren geschädigt.
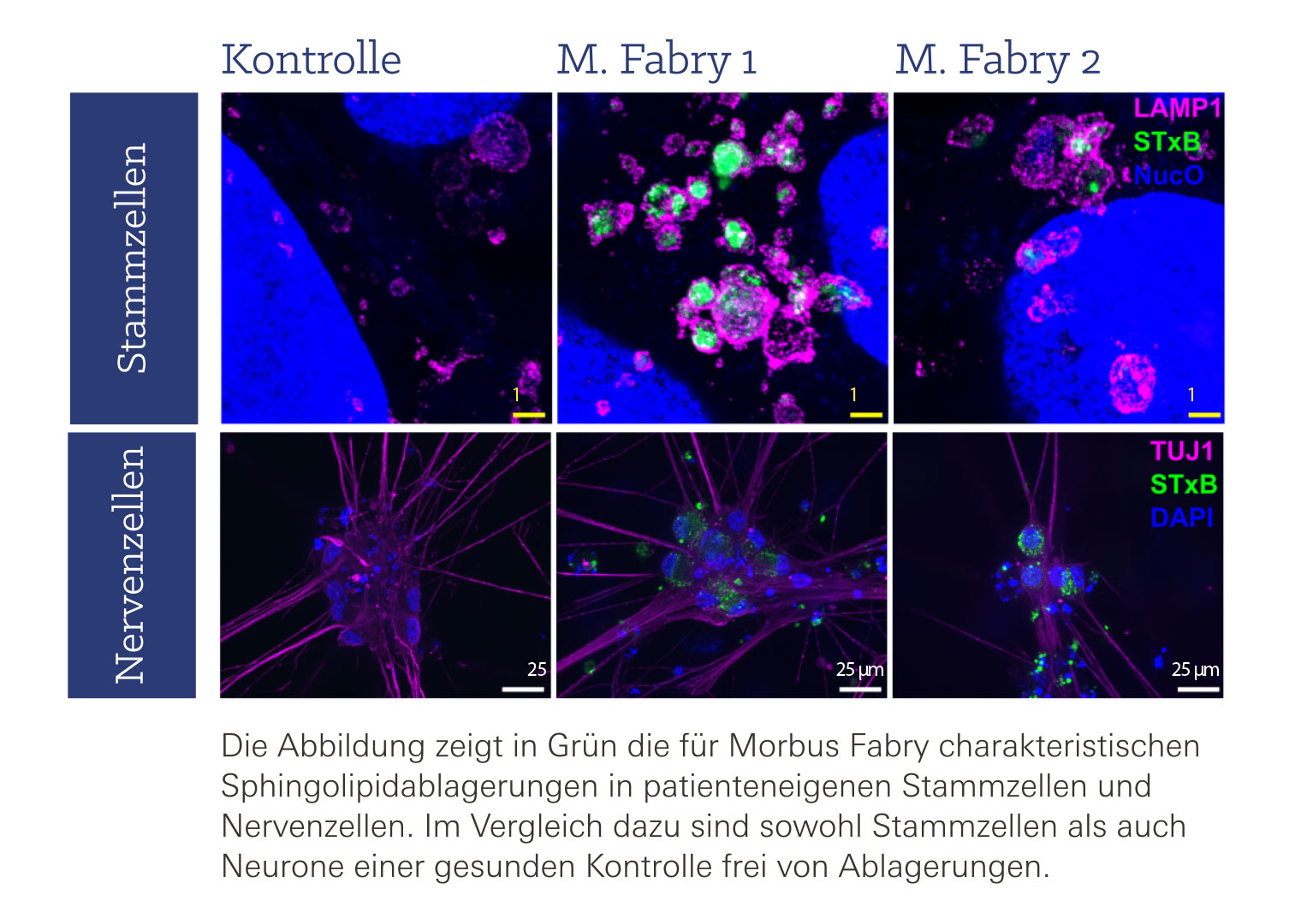
Eine, die sich seit vielen Jahren mit Schmerzen bei Morbus Fabry und der mit der Erkrankung verbundenen Kleinfaserneuropathie beschäftigt, ist Prof. Dr. Nurcan Üçeyler, leitende Oberärztin in der Neurologie des UKW und Professorin für „Translationale Somatosensorik“. Gemeinsam mit klinischen und wissenschaftlichen Kolleginnen und Kollegen hat die Expertin nun in einer von der Deutschen Forschungsgesellschaft (DFG) und dem Interdisziplinären Zentrum für klinische Forschung (IZKF) der Medizinischen Fakultät der Uni Würzburg unterstützten Studie neue molekulare und funktionelle Erkenntnisse gewonnen, die erste Hinweise auf die den Schmerzen und Gefühlsstörungen zugrundeliegenden Mechanismen geben. Aus Hautzellen werden Stammzellen und schließlich Nervenzellen „In unserer Studie ist es uns erstmals gelungen, aus Hautzellen von Patienten mit Morbus Fabry induzierte pluripotente Stammzellen herzustellen, die wir in der Petrischale zu sensiblen Nervenzellen umwandeln konnten. Anhand dieser patienteneigenen Nervenzellen konnten wir zeigen, dass die Ablagerungen zu einer veränderten Aktivität der Nervenzellen führen und möglicherweise auch den Energiehaushalt in den Nervenfasern stören, was zu Schmerzen beitragen kann“, berichtet Prof. Üçeyler. Und Dr. Julia Grüner, Ko-Erstautorin der Studie, fügt hinzu: „Für eine funktionierende Weiterleitung von Reizen benötigen die Nervenzellen bestimmte Kanäle, die sich öffnen sobald ein Signal die Zelle erreicht. Wir konnten in Nervenzellen von Morbus Fabry-Patienten zeigen, dass die Aktivität dieser Kanäle bei erhöhter Temperatur beeinträchtigt ist. Dies könnte zu den typischen, bei Fieber einsetzenden Schmerzen und zur gestörten Temperaturwahrnehmung der Betroffenen beitragen.“ Die neurowissenschaftliche Arbeit wurde nach fast neun Jahren intensiver Forschung im April 2024 in der Fachzeitschrift Brain Communications veröffentlicht. Wie geht es weiter? Die Methoden sollen weiter verfeinert werden, um ein tieferes Verständnis für die Zusammenhänge zwischen Nervenfasern und Hautzellen zu erlangen. Zudem wollen die Forschenden die Schnittstelle zwischen dem peripheren und dem zentralen Nervensystem bei Morbus Fabry auf der Ebene des Rückenmarks untersuchen, dies ebenfalls in vollständig humanen Zellkultursystemen.