Gemeinsame Pressemitteilung der Universitätskliniken Würzburg und Heidelberg
Welche Tumorzellen überleben eine Chemotherapie? Woher kommt das Rezidiv? Denn einen Rückfall müssen leider alle Betroffenen, die an einem Multiplen Myelom erkrankt sind, fürchten. Geheilt werden kann die Krebserkrankung des Knochenmarks, die jedes Jahr sechs bis acht von 100.000 Einwohnern betrifft, noch nicht. Mit einem besseren Verständnis der Evolution dieser entarteten Knochenmarkzellen könnten aber die Diagnose und Behandlung optimiert werden. Einen wertvollen Beitrag dazu haben nun Leo Rasche vom Universitätsklinikum Würzburg und Niels Weinhold vom Universitätsklinikum Heidelberg mit ihren Arbeitsgruppen in ihrer neuesten Publikation im Fachjournal Nature Communications geleistet, in dem sie Antworten auf obige Fragen gesucht und gefunden haben.
Unterschiedliche Tumorzellen an verschiedenen Orten
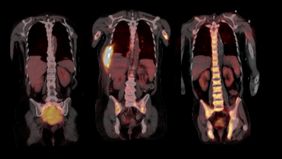
Ihre Arbeit basiert auf Proben aus dem weltweit größten Myelom-Zentrum an der University of Arkansas for Medical Sciences in Little Rock (USA), wo beide Wissenschaftler mehrere Jahre lang gemeinsam geforscht haben. Im Jahr 2017 hatten sie bereits in Nature Communications über die räumliche, genomische Heterogenität der Tumorzellen berichtet. „Bis vor kurzem wurden in der Forschung immer nur einzelne Knochenmarkproben aus dem Becken untersucht. Ein erwachsener Mensch verfügt jedoch über etwa fünf Kilogramm Knochenmark, die sich über das gesamte Skelettsystem verteilen. Somit ließ sich die Evolution der Tumorzellen bislang gar nicht ausreichend abbilden,“ schildert Privatdozent Dr. Leo Rasche, Erstautor der Studie und Juniorgruppenleiter am Mildred-Scheel-Nachwuchszentrum (MSNZ) für Krebsforschung am Uniklinikum Würzburg die Ausgangslage. Die Forscher und ihre Teams haben nun 140 Proben analysiert, die in einem Zeitraum von bis zu 13 Jahren aus verschiedenen Skelettlokalisationen von 24 Myelom-Patientinnen und -Patienten gewonnen wurden. Dazu wurden zum Teil bildgebende Verfahren wie Magnetresonanztomografie (MRT) und Positronen-Emissions-Tomografie (PET) genutzt, um die Tumorherde, die so genannten fokalen Läsionen abzubilden.
Fokale Läsionen sind die Hotspots der Tumor-Evolution
Durch die Nutzung der bildgebenden Verfahren kamen die Wissenschaftler zur ersten wichtigsten Erkenntnis: Dass die entscheidenden Schritte der Tumor-Evolution oft außerhalb des Beckens, in den Tumorherden ablaufen. „In den fokalen Läsionen haben wir Mutationen gefunden, die wir sonst nirgendwo gesehen haben und die aggressiver erschienen, da sie in die Kategorie der so genannten Cancer Driver Genes - genetische Veränderungen, die das Krebswachstum ankurbeln - fielen. Die Eigenschaften der Tumorzellen können sich jedoch nach jeder Therapie-Linie unterscheiden, sogar dann, wenn sich die Tumormasse während der Therapie nicht verändert hat. Wir schließen daraus, dass regelmäßige biologische Untersuchungen des Myeloms während der Therapie erfolgen müssen, wenn die Erkrankung gezielt behandelt werden soll“, resümiert Niels Weinhold, Leiter der Translationalen Myelom-Forschung am Universitätsklinikum Heidelberg.
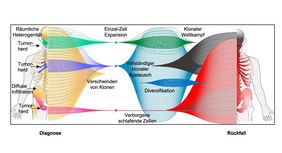
Drei Muster nach Chemo: Einzelne Zelle überlebt, mehrere Zellen an einem Ort, mehrere Zellen an verschiedenen Orten
Insgesamt haben die Forscher drei Muster der Tumor-Evolution entdeckt: Es gibt diejenigen, die in der klinischen Bildgebung zum Zeitpunkt der Erstdiagnose eine gleichmäßige Verteilung der Erkrankung im Knochenmark gezeigt und gut auf die Chemotherapie angesprochen haben. Status MRD-negativ: Minimale Resterkrankung (MRD) nicht vorhanden. Keine Tumorzelle auffindbar. Doch nach zehnjähriger Remission erfolgt ein Rückfall. Gefunden wurde nur ein einzelner Tumorklon. Das heißt, eine einzige resistente Zelle war jahrelang in einem Schlafzustand, wacht auf und führt zum Rezidiv. Auch wenn beim Rezidiv nicht dieselben Tumorzellen (Klone) gefunden wurden wie bei der Erstdiagnose der fokalen Läsion, der Verwandtschaftsgrad ist sehr eng.
Dann gibt es die Gruppe, die nicht so gut auf die Therapie angesprochen hat. Bei ihnen haben entweder mehrere Tumorzellen getrennt voneinander an verschiedenen Orten überlebt, oder verschiedene Klone haben an einer Stelle überlebt und miteinander gerungen. Leo Rasche sieht Parallelen zu den Corona-Viren Delta und Omikron: „Die fittere Variante setzt sich durch. Die evolutionsbiologischen Beobachtungen beim Myelom könnten auch für andere Forschungsbereiche von Bedeutung sein.“
Generell sei bei allen Behandlungen, auch nach vermeintlich erfolgreicher Therapie eine regelmäßige Untersuchung vonnöten. „Wir bitten unsere Patientinnen und Patienten auch in der Remission alle drei Monate zu uns, um eine Kontrolle im Blut durchzuführen und gegebenenfalls mittels MRT oder PET zu prüfen, ob es fokale Läsionen gibt“, schildert Leo Rasche. Unbehandelt versterben die Betroffenen in der Regel innerhalb eines Jahres.
Immuntherapie als Hoffnungsträger
Die große Hoffnung der Forscher ist es, in der Behandlung des Multiplen Myeloms alle Tumorzellen, auch die einzelne schlafende Zelle, zu erwischen und zu vernichten. Schon jetzt kommen immer häufiger moderne Immuntherapien mit Antikörpern oder Gen-manipulierten T-Zellen, den sogenannten CAR-T-Zellen, zum Einsatz. Der Einfluss dieser neuen Therapien auf die Evolution des multiplen Myeloms und die Rolle der Tumor-Mikroumgebung an verschiedenen Stellen im Knochenmark sind jedoch noch weitestgehend unbekannt und daher Gegenstand aktueller Untersuchungen der beiden Forscher: „Wir haben das Ziel, dass noch mehr Patientinnen und Patienten von den modernen Immuntherapien profitieren und wir die bislang unheilbare Erkrankung Multiples Myelom eines Tages heilen können.“
Unterstützt wurden die Forschungsarbeiten von der Deutschen Krebshilfe über das Mildred-Scheel-Nachwuchszentrum, der Dietmar Hopp Stiftung sowie dem National Institute of General Medical Sciences of the National Institutes of Health.
Publikationen:
Rasche L., Schinke C., Maura F., Bauer M., Ashby C, Deshpande S., Poos A., Zangari M., Thanendrarajan S, Davies F, Walker B, Barlogie B, Landgren O, Morgan G, van Rhee F & Weinhold N. The spatio-temporal evolution of multiple myeloma from baseline to relapse-refractory states. Nat Commun 13, 4517 (2022). https://doi.org/10.1038/s41467-022-32145-y
Rasche L, Chavan SS, Stephens OW, Patel PH, Tytarenko R, Ashby C, Bauer M, Stein C, Deshpande S, Wardell C, Buzder T, Molnar G, Zangari M, van Rhee F, Thanendrarajan S, Schinke C, Epstein J, Davies FE, Walker BA, Meissner T, Barlogie B, Morgan GJ, Weinhold N. Spatial genomic heterogeneity in multiple myeloma revealed by multi-region sequencing. Nat Commun. 2017 Aug 16;8(1):268. doi: 10.1038/s41467-017-00296-y. PMID: 28814763; PMCID: PMC5559527.