Würzburg. Oh My Bone. Der Name des neuesten Forschungsprojekts der Würzburger Professorinnen Franziska Jundt und Regina Ebert ist Programm. Es geht um Knochen (Bone), die bei der Tumorerkrankung Multiples Myelom (My) porös werden, sowie um den Einfluss von Fettleibigkeit (Obesity) und der Intensität von mechanischer Belastung (hyper-/hypo-mechanichal loading) bei der Knochenregeneration.
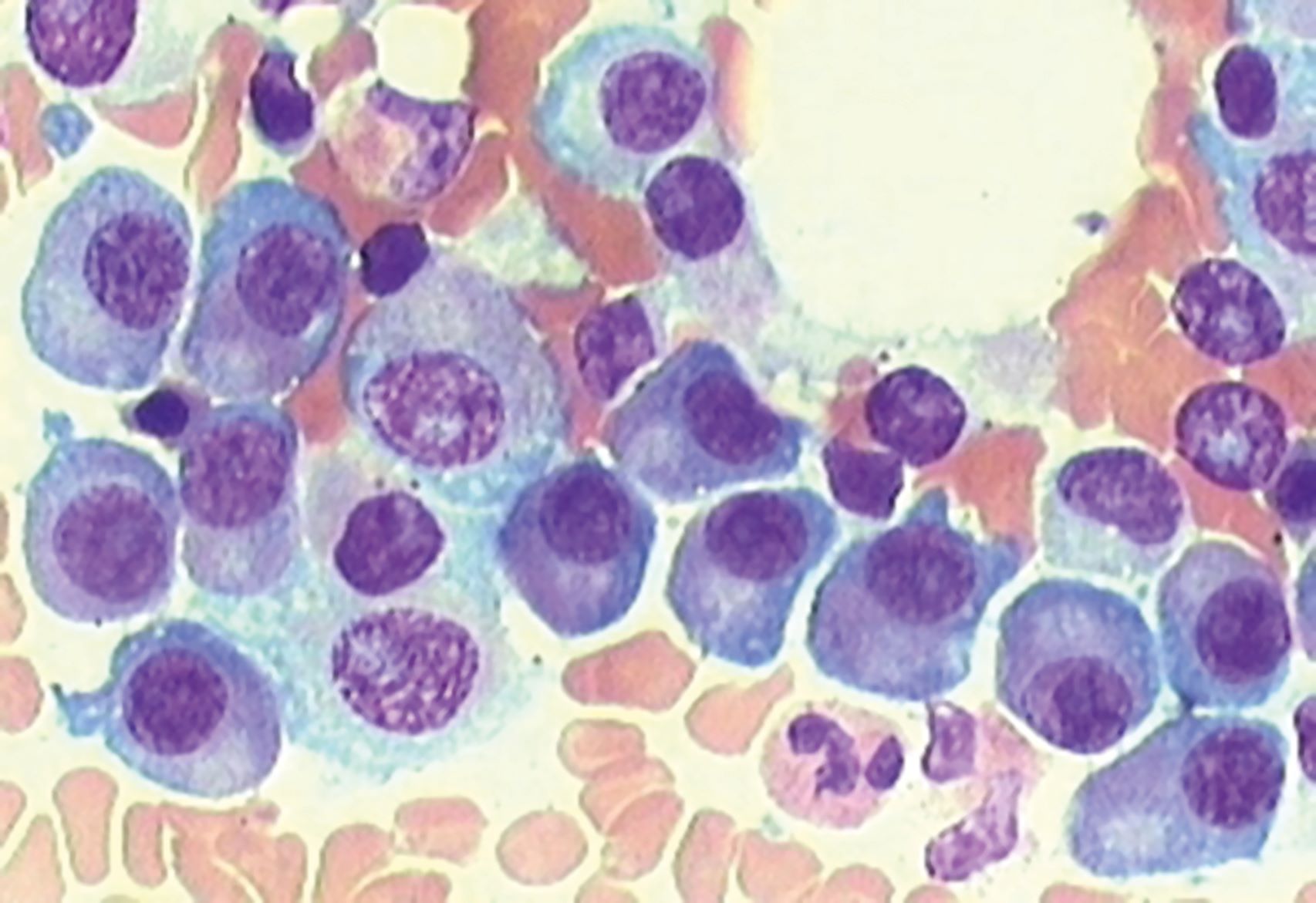
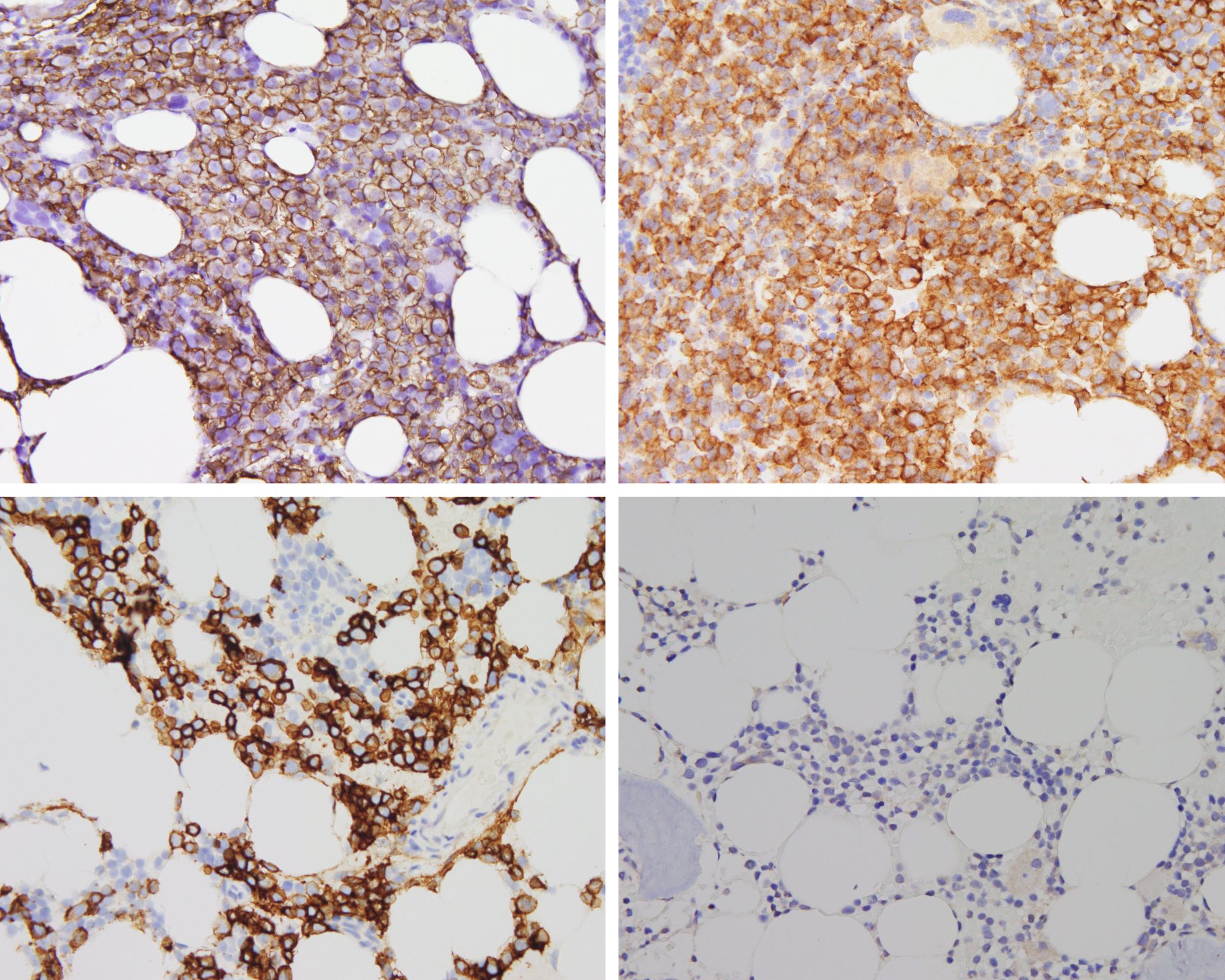
„Bei der Blutkrebserkrankung Multiples Myelom greifen die bösartigen Plasmazellen im Knochenmark in den Knochenstoffwechsel ein. In der Folge bilden sich Löcher im Knochen, die zu Brüchen und massiven Schmerzen bei den Patientinnen und Patienten führen können“, erläutert Prof. Dr. Franziska Jundt, Oberärztin der Medizinischen Klinik und Poliklinik II des Universitätsklinikums Würzburg und Leiterin des Zentrums für das Myelom im Zentrum für Seltene Erkrankungen Nordbayern (ZESE). „Selbst wenn eine Therapie erfolgreich die Tumorzellen im Knochenmark beseitigt, bleiben die Löcher im Knochen oftmals erhalten. Es wird keine neue Knochensubstanz aufgebaut“, ergänzt Prof. Dr. Regina Ebert, Biologin am Lehrstuhl für Regeneration Muskuloskelettaler Gewebe der Julius-Maximilians-Universität Würzburg an der Orthopädischen Klinik König-Ludwig-Haus.
Mechanische Stimulation kann Schwere einer Knochenerkrankung entgegenwirken
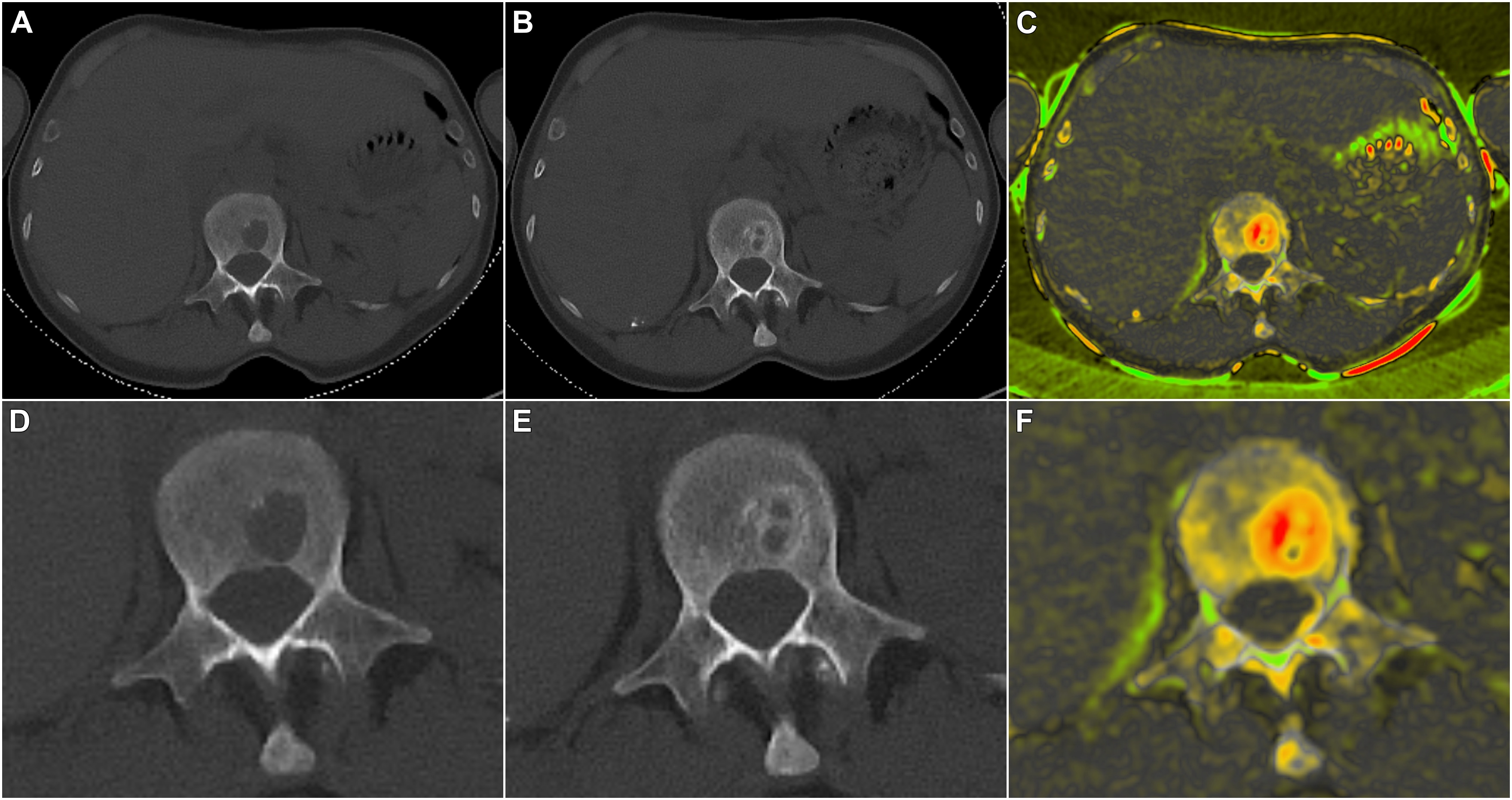
Doch es gibt Hoffnung. Die Wissenschaftlerinnen konnten bereits an Mäusen mit Multiplem Myelom zeigen, dass eine mechanische Stimulation dem Knochenabbau entgegenwirkt, die Knochenheilung fördert und sogar das Tumorwachstum bremsen kann. Nun wollen Franziska Jundt und Regina Ebert untersuchen, ob ein Wiederaufbau der Knochenstruktur auch dann möglich ist, wenn neben der Myelom-Knochenerkrankung eine Fettleibigkeit vorliegt. „Patientinnen und Patienten mit Multiplen Myelom und starkem Übergewicht haben ein höheres Risiko ein Multiples Myelom zu entwickeln“, weiß Franziska Jundt. „Wir wollen verstehen, wie sich die Myelom-Knochenerkrankung bei Fettleibigkeit auf die Knochen auswirkt und wie mechanische Belastung in dieser Situation helfen kann, die Krankheit zu behandeln.“
Risiko steigt mit zunehmender Adipositas und Bewegungsmangel
Da die Zahl der Menschen mit Fettleibigkeit (Body Mass Index von 30 und höher) in den vergangenen Jahren stark gestiegen ist und weiter zunimmt - die Weltgesundheitsorganisation (WHO) spricht von einer "Adipositas-Epidemie" - müsse man sich auch die Frage stellen, wie sich starkes Übergewicht auf die Entstehung und den Verlauf von Tumorerkrankungen generell auswirkt und ob man durch Stimulation von Muskeln und Knochen der Entwicklung und Ausbreitung von Tumorzellen im Knochen entgegenwirken kann. Auch der Bewegungsmangel ist auf einem neuen Rekordhoch (siehe Global status report on physical activity 2022). Daher interessiert die Wissenschaftlerinnen auch, wie sich ein inaktiver Lebensstil auf den Verlauf der Myelom-Erkrankung auswirkt.
Deutsch-Französische Kooperation
Unterstützt werden sie dabei von Prof. Dr. Maura Strigini und Prof. Laurence Vico von der Université Jean Monnet in St. Etienne sowie Dr. Luciano Priola von der Université Lyon. Gemeinsam konnten sie bei der Deutschen Forschungsgemeinschaft DFG insgesamt 644.821 Euro einwerben und weitere 420.000 Euro bei der französischen Agence Nationale de la Recherche (ANR).
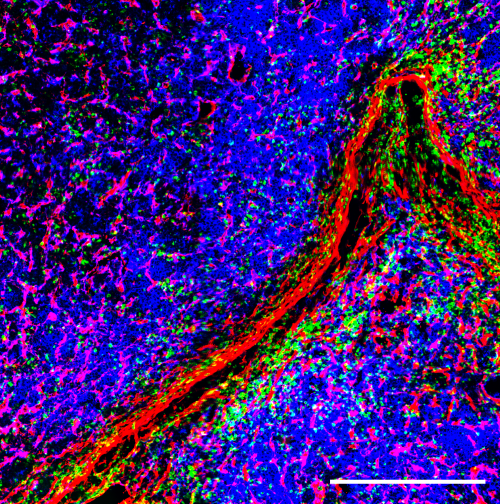
Um die Mikroarchitektur des Knochens zu untersuchen und die Tumorlast zu messen verwenden die Forschenden neben Tiermodellen auch zwei- und dreidimensionale Zellkulturmodelle. In Würzburg werden momentan die für das Projekt relevanten Zellkulturmodelle aufgebaut. „Wir werden Vorläuferzellen des Knochens zu reifen Osteozyten, den mechanosensitiven Zellen des Knochens auf einer dreidimensionalen Matrix differenzieren und diese in einem Bioreaktor mechanisch stimulieren“, verdeutlicht Regina Ebert das Vorhaben.
Inaktivität vermeiden!
Eine Empfehlung können die Wissenschaftlerinnen aber jetzt schon geben, bevor das Projekt richtig angelaufen ist: „Vermeiden Sie Inaktivität und bewegen Sie sich grundsätzlich so viel, dass Muskeln und Knochen beansprucht werden. Ideal ist es, wenn man mindestens 30 Minuten am Tag flott spazieren geht, mit dem Fahrrad fährt oder regelmäßig Krafttraining betreibt.“
Weitere Forschungsförderungen der DFG zum Thema Myelom-Knochenkrankheit:
Regina Ebert und Franziska Jundt werden zudem im Schwerpunktprogramm µbone der DFG gefördert. Für ihr Projekt „Molekulare Dissektion der Signalwege, die knochenaufbauende und antitumorale Wirkungen physikalischer Stimuli bei der Myelom-Knochenkrankheit ausüben“ erhalten sie 554.000 Euro. Mit weiteren 363.589 Euro unterstützt die DFG das Projekt von Franziska Jundt mit dem Titel: „Identifizierung des frühen Fußabdrucks der Myelom-Knochenerkrankung: räumlich-zeitliche Kartierung und Quantifizierung von Biomarkern der extrazellulären Matrix in einem Mausmodell und menschlichen Knochenbiopsien.“ Und das Projekt von Regina Ebert „Molekulare und funktionelle Charakterisierung des Interfaces zwischen normalen und malignen Plasmazellen und Knochenzellen – von der Einzel-Zell-Analyse der wechselseitigen Interaktionen zu deren klinischen Implikationen für die Knochenerkrankung und das Überleben beim Multiplen Myelom“ wird von der DFG mit 310.000 Euro gefördert.