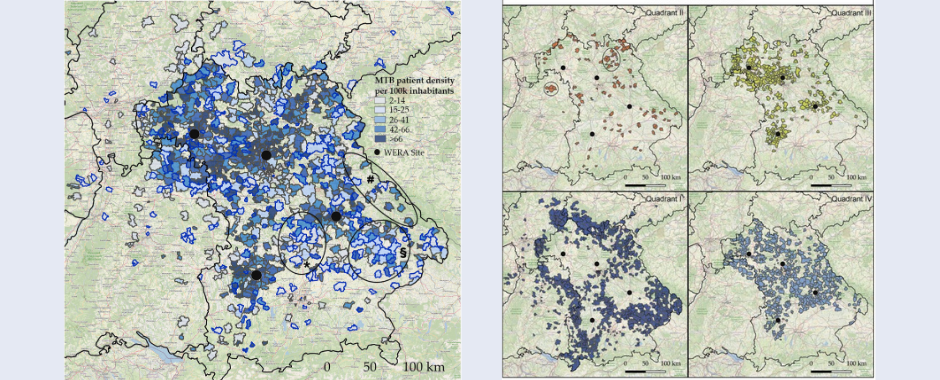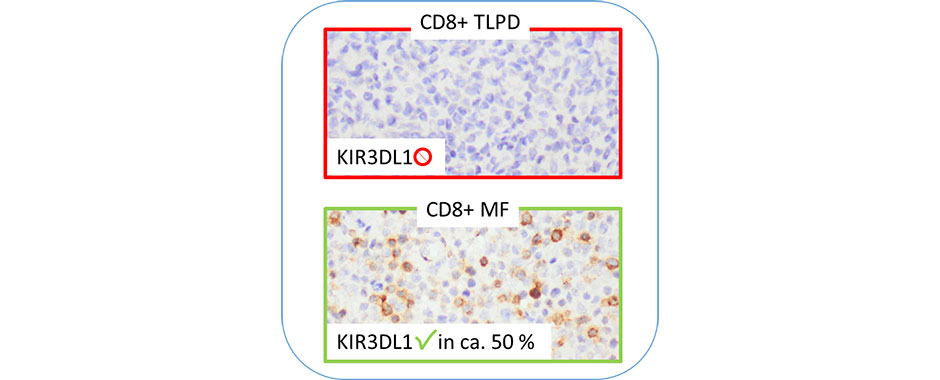
Die Überwachung von Vitalparametern wie Herzfrequenz, Blutdruck und Sauerstoffsättigung erfolgt bisher kontinuierlich über verschiedene Monitorkabel, die an der Patientin oder am Patienten befestigt sind und dessen Mobilität stark einschränken. Im Rahmen der Monitor-Studie wurden nun erstmals die Zuverlässigkeit und Messgenauigkeit verschiedener Fitnesstracker zur kontinuierlichen drahtlosen Überwachung von Herzfrequenz, Atemfrequenz und Sauerstoffsättigung untersucht und neue Möglichkeiten für die Zukunft aufgezeigt. Mit Hilfe der Ergebnisse sollen zukünftig mobile Sensorsysteme zur Überwachung von Vitalparametern etabliert werden, die insbesondere im Gegensatz zum derzeitigen klinischen Standard die Patientinnen und Patienten nicht mehr in ihrer Bewegungsfreiheit einschränken.
Philipp Helmer, Sebastian Hottenrott, Kathrin Wienböker, Rüdiger Pryss, Vasileios Drosos, Anna Katharina Seitz, Daniel Röder, Aleksandar Jovanovic, Jürgen Brugger, Peter Kranke, Patrick Meybohm, Bernd E Winkler, Michael Sammeth. Reliability of continuous vital sign monitoring in post-operative patients employing consumer-grade fitness trackers: A randomised pilot trial. Digit Health (2024). doi:10.1177/20552076241254026