Neuer hochwirksamer Thrombosehemmer in Sicht
Der GPVI-Inhibitor EMA601 verspricht eine effiziente Prävention und Behandlung arterieller Thrombosen und Entzündungsreaktionen – und das, ohne das Blutungsrisiko zu erhöhen.
Prof. Dr. Bernhard Nieswandt (links) und Dr. Stefano Navarro im Labor des Rudolf-Virchow-Zentrums.
Das Glykoprotein VI, kurz GPVI, findet sich ausschließlich in Thrombozyten – auch bekannt als Blutplättchen – und ihren Vorläuferzellen im Knochenmark. Der Oberflächenrezeptor ist vor allem für die Bindung von Kollagen an verletzten Gefäßwänden verantwortlich, was die Aktivierung und Aggregation, also das Verklumpen der Blutplättchen auslöst. So können die kleinen, kernlosen Zellen die Blutungen nach Verletzungen stillen. Eine übermäßige Aktivierung von GPVI kann jedoch zur Bildung krankhafter Thromben und damit zu Gefäßverschlüssen sowie akut bedrohlichen Ereignissen wie Herzinfarkt oder Schlaganfall führen. Darüber hinaus sind Thrombozyten maßgeblich an Entzündungsreaktionen beteiligt und auch hier ist GPVI von zentraler Bedeutung. Weiterer Schritt einer 25-jährigen Forschungsarbeit „Die Würzburger Forschungsarbeiten der vergangenen 25 Jahre zeigten eindrücklich, dass GPVI eine vielversprechende Zielstruktur für anti-thrombotische und anti-entzündliche Therapien ist und legten damit das Fundament für die Entwicklung und klinische Erprobung von GPVI-Inhibitoren“, erklärt Prof. Dr. Bernhard Nieswandt, Leiter des Lehrstuhls für Experimentelle Biomedizin I am UKW und Forschungsgruppenleiter am Rudolf-Virchow-Zentrum (RVZ) der Uni Würzburg. Der Biologe entdeckte einen Mechanismus, mit dem GPVI sowohl gehemmt, als auch ausgeschaltet werden kann. Ein erstes Medikament, der GPVI-Hemmer ACT017/Glenzocimab, wurde inzwischen von einer französischen Forschungsgruppe – basierend auf der Grundlagenforschung der Würzburger Universitätsmedizin – in die klinische Phase III gebracht. „Erste klinische Daten mit diesem GPVI-Hemmer bei Schlaganfallpatientinnen und -patienten, die kürzlich veröffentlicht wurden, waren sehr vielversprechend und deuten darauf hin, dass dieser therapeutische Ansatz im Menschen funktionieren kann“, sagt Prof. Nieswandt.
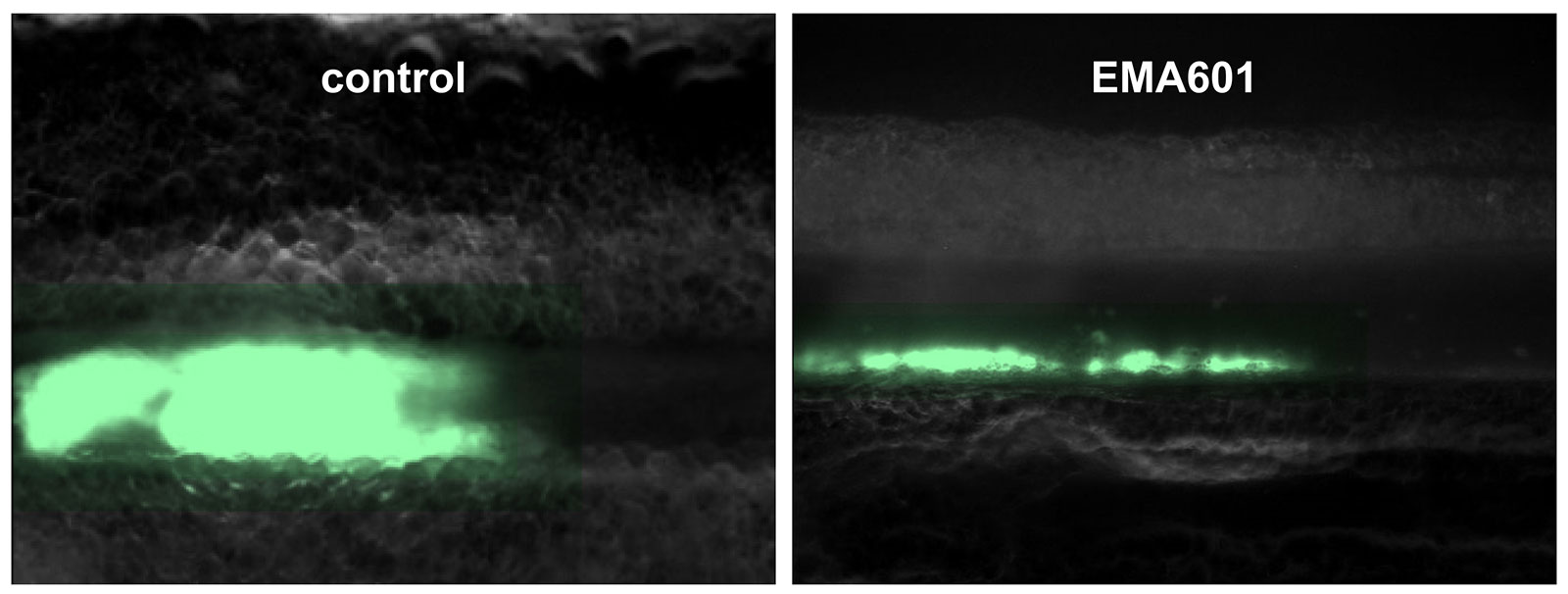
Das linke Bild zeigt ein Gerinnsel (grün), das das gesamte Gefäß blockiert. Im Gegensatz dazu verschließen die Thrombozyten nach der Behandlung mit EMA601 die Verletzung, bilden jedoch keinen verstopfenden Thrombus.
50-fach potenteren Antikörper entwickelt Auch sein Team entwickelte einen GPVI-blockierenden Antikörper, der in seiner Wirksamkeit die bisherigen Wirkstoffe weit übertrifft, sogar bei sehr niedrigen Dosen, und dabei gleichzeitig das Blutungsrisiko nicht erhöht. Hierzu veröffentlichten Prof. Nieswandt und sein Team im August dieses Jahres eine Studie im European Heart Journal.
„Unser Antikörper ist um den Faktor 50 potenter als die bislang beschriebenen GPVI-Inhibitoren und dürfte daher eine höhere klinische Wirksamkeit und breitere Einsatzmöglichkeiten haben“, meint Nieswandt.
Entwickelt wurde der GPVI-Inhibitor EMA601 von der unterfränkischen Biotech-Firma EMFRET Analytics, die Nieswandt einst mitbegründete. Funktionell untersucht wurde EMA601 von Forschenden des UKW, des RVZ und der Uni Würzburg, allen voran von Dr. Stefano Navarro vom Lehrstuhl für Experimentelle Biomedizin I. Er analysierte in seiner Doktorarbeit sowohl Antikörperfragmente von Mäusen als auch humanisierte Antikörper in vitro und in vivo und fungiert als Erstautor der Publikation. Navarros Fazit: „EMA601 ist ein konzeptionell neuartiger und vielversprechender Wirkstoff zur Behandlung und Sekundärprophylaxe von Blutgerinnseln, um Infarkte zu verhindern, aber auch zur Unterdrückung von Entzündungsprozessen, die durch Blutplättchen verursacht werden und lebenswichtige Organe schädigen können.“
Mechanismen antibiotikaresistenter Lyme-Arthritis entschlüsselt
Ein Team der Kinderklinik des UKW zeigt, wie bestimmte Zellen des Immunsystems die durch einen Zeckenstich ausgelöste Borrelien-Infektion zunächst bekämpfen und dann bei manchen Menschen eine Fehlreaktion auslösen, die zu einer chronischen Gelenkentzündung führt.


Dr. Johannes Dirks (links) und PD Dr. Henner Morbach bieten mit ihrer neuen Studie einen Fahrplan, der erklärt, wie T-Zell-Reaktionen, die zur Kontrolle einer Infektion notwendig sind, trotz Antibiotikatherapie nachteilige Effekte auslösen können, was zu einer postinfektiösen, entzündlichen Arthritis führt.
Die Wanderröte ist ein erster Hinweis auf eine Lyme-Borreliose. Sie ist die häufigste von Zecken übertragene Krankheit in Europa und Nordamerika. Wird sie nicht rechtzeitig therapiert, können sich die Borrelia burgdorferi-Bakterien im Körper ausbreiten und langfristige Beschwerden wie Gelenkentzündungen verursachen. In den meisten Fällen kann die sogenannte Lyme-Arthritis mit Antibiotika behandelt werden, aber bei einem kleinen Prozentsatz bessert sich der Zustand trotz Beseitigung der Bakterien nicht. Diese Form der Arthritis wird als antibiotikaresistente Lyme-Arthritis (ALRA) bezeichnet.
Obwohl bekannt ist, dass Immunzellen eine entscheidende Rolle bei der Aufrechterhaltung der chronischen Entzündung spielen, waren die genauen molekularen Mechanismen der antibiotikaresistenten Verlaufsformen der Lyme-Arthritis bislang unklar. Dr. Johannes Dirks und Privatdozent Dr. Henner Morbach von der Pädiatrischen Entzündungsmedizin des UKW haben nun gemeinsam mit einem interdisziplinären Team zentrale Fehlreaktionen des Immunsystems entschlüsselt.
Unter anderem entdeckten sie in den Gelenken von ARLA-Patientinnen und -Patienten eine besondere Art der Immunantwort, die durch spezifische T-Zell-Rezeptoren (TCR) gesteuert wird und über einen langen Zeitraum anhält. Die Forschenden identifizierten ein charakteristisches Muster in den TCR, das ARLA-Patientinnen und -Patienten von anderen rheumatischen Erkrankungen unterscheidet: das sogenannte TCR-β-Motiv. Die Struktur in der β-Kette des TCR wird von T-Zellen genutzt, um fremde oder veränderte körpereigene Moleküle zu erkennen. T-Zell-Rezeptoren halten pathogene T-Helferzell-Reaktionen aufrecht Die TCR-gesteuerte Immunantwort führt zu einer starken Vermehrung von T-peripheren Helferzellen (Tph-Zellen). Tph-Zellen senden entzündungsfördernde Signale aus und scheinen die chronische Entzündung in den Gelenken fortzuführen. „Wir konnten erstmals das Genexpressionsmuster krankheitsspezifischer T-Zellen in den betroffenen Gelenken verfolgen. Diese Erkenntnisse sollen in weiteren Studien vertieft werden, um herauszufinden, gegen welche Strukturen sich die Immunantwort richtet – ob es sich um eine Autoimmunreaktion handelt oder um Bestandteile nicht mehr lebensfähiger Borrelien, die die Entzündung aufrechterhalten“, sagt Dr. Dirks. Auswirkungen auf Diagnose und Behandlung Durch die Entdeckung spezifischer Immunmarker könnte es künftig möglich sein, die Erkrankung früher zu diagnostizieren und von anderen chronischen Gelenkentzündungen zu unterscheiden. Auch die Erkenntnisse über die Rolle der Tph-Zellen und des TCR-β-Motivs bieten neue Ansätze für therapeutische Interventionen. „Unsere Ergebnisse unterstreichen die Notwendigkeit, das überschießende Immunsystem frühzeitig ins Visier der Therapie zu nehmen, statt immer wieder auf Antibiotika zu setzen“, betont Dr. Morbach.
Die von der Deutschen Forschungsgesellschaft geförderten Untersuchungen wurden im Juli 2024 im Journal of Clinical Investigation veröffentlicht.